هر آنچه باید درباره بیماری زوال عقل و آلزایمر بدانیم

بیماری آلزایمر و زوال عقل یکسان نیستند، با اینکه اغلب به جای همدیگر استفاده میشوند. زوال عقل واژهای کلی است و برای هر نوع کاهش توانایی ذهنی شدید که سلامت بدن و زندگی روزمره را مختل کند، استفاده میشود. آلزایمر نوعی از زوال عقلی است که باعث از دست رفتن حافظه و ایجاد اختلال در سایر کارکردهای مهم ذهنی میشود. بیماری آلزایمر ۶۰ الی ۸۰ درصد کل موارد زوال عقل را شامل میشود. این بیماری یک بیماری پیشرونده است؛ یعنی علایم بیماری بهتدریج و با گذشت زمان تشدید میشوند. بیماری آلزایمر ششمین عامل اصلی مرگ در آمریکا است. مبتلایان به این بیماری، بهطور میانگین تا هشت سال پس از ظهور علائم آشکار بیماری زنده میمانند.
مغز انسان از حدود ۱۰۰ میلیارد نورون تشکیل شده است و آلزایمر باعث از بین رفتن میلیونها سلول عصبی میشود و در مراحل پیشرفته به کوچک شدن محسوس مغز منجر خواهد شد. اصلیترین مشکلی که بیماری آلزایمر ایجاد میکند، مختل کردن ارتباطات بین نورونهای مغزی است؛ نورونهایی که وظیفهی آنها پردازش و انتقال سیگنالها بین مناطق مختلف مغز است. این عاملی است که باعث مرگ سلولهای مغزی میشود و مربوط به ساخته شدن پروتئینهای آمیلوئید (amyloid) و تائو (tau) است. تعامل دقیق بین این پروتئینها تا حد زیادی ناشناخته است.
آنچه که میدانیم این است که آمیلوئیدها در دستههای چسبندهای به نام پلاکهای بتا-آمیلوئید تجمع مییابند و پروتئینهای تائو در داخل سلولهای درحال مرگ، بهصورت تودههای نوروفیبریلی انباشته میشوند. مسئلهی مهم دیگر این است که پلاکهای بتا-آمیلوئید در مغز افراد سالم هم یافت میشود. این موضوع نشان میدهد که حضور پروتئینهای آمیلوئید و تائو اطلاعات قطعی و دقیقی را در مورد بیماری به ما نمیدهند. مطالعهی جدیدی نشان میدهد که التهاب مزمن ممکن است در ایجاد این بیماری نقش ایفا کند.
التهاب بخشی از پاسخ سیستم ایمنی بدن در برابر بیماریها است و زمانی رخ میدهد که گلبولهای سفید مواد شیمیایی خاصی را برای محافظت از بدن در برابر جسم خارجی ترشح کنند. با این حال طولانی شدن التهاب و مزمن بودن آن میتواند به بدن آسیب بزند. در مغز، التهاب مزمن آسیبزننده به بافتها ممکن است در اثر افزایش «میکروگلیاها» رخ دهد. در مغز سالم این سلولها مواد زاید و سمی را احاطه و تخریب میکنند. در بیماران آلزایمری، میکروگلیاها نمیتوانند مواد زایدی مانند پلاکهای آمیلوئید-بتا و تودههای تائو را از سلول پاکسازی کنند و واکنش بدن به این شرایط افزایش تعداد میکروگلیاها است. افزایش این سلولها موجب بروز التهاب میشود. پس التهاب مزمن بهطور خاص به سلولهای مغزی آسیب میزند و درنهایت باعث مرگ آنها خواهد شد.
انواع دمانس یا زوالعقل

بیماری آلزایمر
پس از مرگ و کالبدشکافی، دکتر آلزایمر متوجه شد که مغز «آگوست دتر» بسیار کوچکتر از حالت عادی شده و چربی زیادی در میان سلولهای مغزیاش به وجود آمده است. این بیماری، در سال ۱۹۰۶ توسط دکتر آلویز آلزایمر کشف و به همین دلیل نام او بر آن گذاشته شد. او با بررسی مغز او، به بیماری آلزایمر پی برد. پیش از مرگ خانم دتر علائم بسیاری را که امروزه ما به عنوان علائم آلزایمر میشناسیم از جمله اشکالات عمده در تکلم و شناختن دیگران، از خود نشان میداد. امروزه، حداقل ۴.۵ میلیون نفر در ایالات متحدهی آمریکا به آلزایمر مبتلا هستند. در واقع این رقم از پنج درصد آمریکاییهایی که بین ۶۵ تا ۷۵ سال سن دارند، تشکیل شده است. میزان شیوع بیماری میان افراد ۸۵ سال به بالا در حدود ۵۰ درصد اعلام شده است.
آلزایمر نوعی بیماری مغزی است که بیشتر در سالمندان بروز پیدا میکند اما ممکن است در برخی افراد در سنین پایین و در حدود چهل سالگی نیز دیده شود. این بیماری شایعترین عامل زوال عقل و پیشرونده است، یعنی با گذر زمان وخیمتر میشود. بیماری آلزایمر باعث تغییر اعصاب مغز میشود؛ در نتیجهی این تغییر اعصاب ارتباطشان را با یکدیگر از دست میدهند. معمولا افرادی که دچار آلزایمر میشوند، پس از بروز اولین نشانههای بیماری حدود ۱۰ سال بیشتر زنده نمیمانند اما در برخی از آنها، امید به زنده ماندن تا ۲۰ سال هم میرسد.
سن مهمترین عامل مؤثر در بروز آلزایمر است؛ عوامل دیگری ازجمله وراثت، ابتلا به دیابت، فشار خون، صدمات مغزی و تغذیهی نامناسب در بروز آلزایمر موثرند. با پیشرفت بیماری، ضعف حافظهی کوتاهمدت شدت میگیرد بهطوریکه فعالیتهای روزمرهی فرد دچار اختلال میشود. آلزایمر خفیف باعث میشود فرد برای انجام فعالیتهای روزمره تا حدودی به کمک نیاز داشته باشد. با وخیمتر شدن بیماری ممکن است کمک برای انجام کارهای روزمره مانند تهیهی غذا، استحمام و شستوشو ضروری شود. مبتلایان به آلزایمر شدید برای تهیهی خوراک و استحمام کاملا به دیگران وابستهاند و ممکن است بدون کمک دیگران حتی قادر به استفاده از دستشویی نباشند.
دمانس لوب پیشانی-گیجگاهی (FTD)
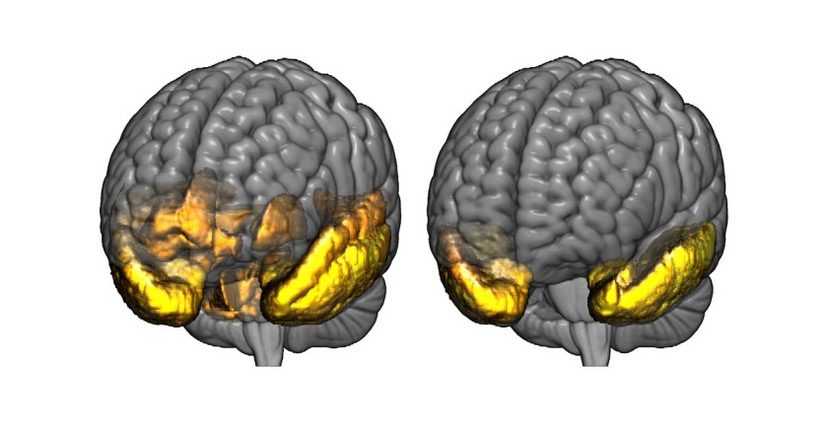
اگر همسر شما مبتلا به FTD است، او در مناطقی از مغزش که مسئول کنترل کردن برنامهریزی، قضاوت، احساسات، صحبت کردن و حرکت کردن است، دچار تخریب سلولی شده است. مغز انسان، مانند کرهی جغرافیا، مناطق مختلفی مانند قارهها، ولی به هم پبوسته، به نام لوبهای مغزی دارد. در قسمتهای قدامی و طرفی، دو لوب اصلی وجود دارند که به آنها به ترتیب لوبهای پیشانی و آهیانهای میگویند. لوبهای پیشانی مرکز توجه، برنامهریزی، قضاوت و هر آن چیزی است که ما را بهعنوان انسان متمدن از پیشینیانمان جدا میکند. کار اصلی لوبهای آهیانهای، کمک به ذخیرهسازی حافظه و همچنین حفظ گنجینهی لغات ما است.
از بین رفتن سلولهای عصبی در دمانس دمانس لوب پیشانی–گیجگاهی، در این دو قسمت اصلی مغز شروع میشود و با پیشرفت بیماری، به سایر قسمتها گسترش مییابد. دمانس لوب پیشانی–گیجگاهی، معمولا در سنین ۵۰ و ۶۰ سالگی بروز میکند ولی بیمارانی در سنین ۲۱ سالگی و ۸۰ سالگی نیز مشاهده شدهاند. حدود ۶۰ درصد بیماران این نوع دمانس، در ۴۵ تا ۶۴ سالگی، که سنین فعالیت حرفهای، کسب درآمد، و پشتیبانی از همسر و فرزندان است، به آن دچار میشوند. در نتیجه، بار مالی بروز این نوع دمانس بر خانوادهها، از سایر موارد دمانس سنگینتر است. تغییرات رفتاری و تکلمی در این گروه بیماری میتواند به حدی شدید باشد که بار مراقبت سنگینتری از بیماری آلزایمر را بر مراقبینش تحمیل کند. شایعترین انواع دمانس پیشانی-گیجگاهی عبارتند از:
- فرونتال واریانت (Frontal variant)
این نوع از زوال عقل بر رفتار و شخصیت فرد اثر میگذارد.
- زبانپریشی پیشروندهی اولیه (Primary progressive aphasia)
زبانپریشی یا آنطور که بیشتر رایج است آفازی، به معنی مشکل در برقراری ارتباط است. این نوع آفازی خود به دو گروه تقسیم میشود: آفازی پیشروندهی کلامی که توانایی سخن گفتن را تضعیف میکند و آفازی معنایی که توانایی استفاده و فهم زبان را تحتتاثیر قرار میدهد. عامل بروز دمانس پیشانی-گیجگاهی مشخص نیست؛ پژوهشگران برخی از انواع آن را ناشی از جهشهای ژنتیکی میدانند. ساختار سلولهای مغز برخی از مبتلایان به این بیماری حاوی مقادیر غیرطبیعی پروتئین است.
دمانس عروقی
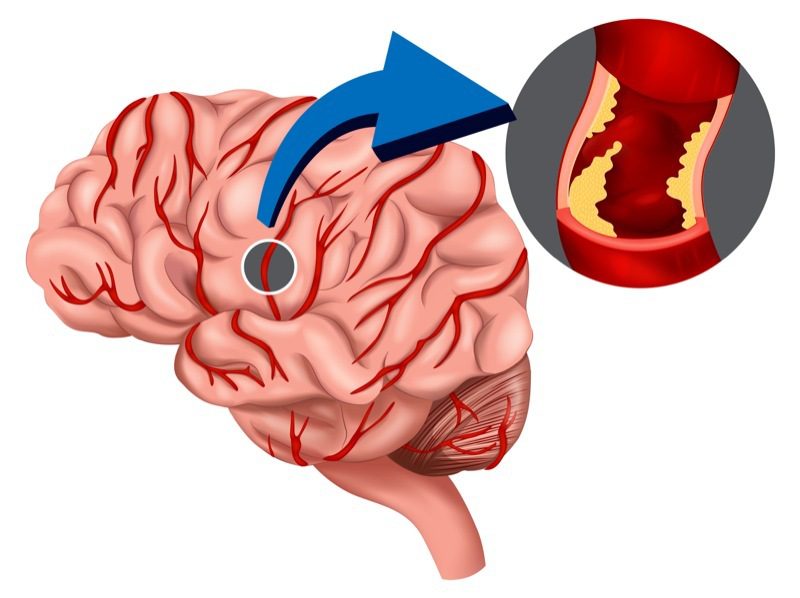
نوع شایع دمانس پس از آلزایمر، دمانس عروقی است که حدود ۱۰ درصد کل بیماران دمانس را شامل میشود و تعداد مبتلایان به آن در آمریکا بالغ بر ۱٫۴ میلیون نفر است. این نوع دمانس در اثر مسدود شدن یا پارگی عروق مغزی و نرسیدن اکسیژن و غذا به سلولهای عصبی مغز و از بین رفتن آنها به وجود میآید. در این نوع دمانس علایم بیماری ممکن است بهصورت پلکانی و هر علامت به صورت ناگهانی ظاهر شود. برای مثال بیمار ممکن است بعد از یک سکته مغزی نتواند به سطح قبلی عملکرد ذهنی خود باز گردد و در صورت سکته مغزی مجدد، عملکرد بیمار در زمینه تازهای افت کند. سکتههای مغزی همیشه با علایم پر سر و صدا مانند فلج ناگهانی بروز نمیکنند. سکتههای کوچک و متعدد ممکن است آنقدر بدون علامت باشند که برای بیمار و همراهانش علامت آشکاری ایجاد نکنند.
بیشتر بیماران مبتلا به دمانس عروقی، به بیماریها و عوارض دیگر از جمله دیابت، فشار خون، و میزان بالای کلسترول نیز دچارند و بسیاری از آنها، دخانیات مصرف میکنند. این نوع دمانس در سنین سالمندی بیشتر شایع است ولی موارد زیر ۶۰ سالگی نیز وجود دارد. بروز اختلال و عوارض در این بیماران متفاوت است. اختلال در قضاوت و توان تصمیمگیری در برنامهریزیهای معمول روزانه، ممکن است در کنار عوارض فیزیکی مانند اختلال در راه رفتن، فلج شدن یا بیحسی یک طرف صورت یا یک نیمه از بدن بیمار بروز کند. محل ایجاد صدمات عروقی، شدت به وجود آمدن آنها، و تعداد سکتهها، مستقیما بر میزان توان فکری و فیزیکی بیمار تأثیرگذار است. نشانههای دمانس عروقی ممکن است بهتدریج یا پس از سکته یا عمل جراحی سنگین مانند بایپس قلبی یا جراحی شکمی آشکار شود.
دمانس مختلط
حدود ۱۰ درصد مبتلایان به بیماری دمانس به بیش از یک نوع دمانس دچار میشوند که به آن دمانس مختلط میگویند. شایعترین دمانس مختلط، حضور همزمان آلزایمر و دمانس عروقی در فرد بیمار است.
دمانس با اجسام لویی (ِDLB)
لوییبادی رسوبات پروتئین هستند که بهصورت میکروسکوپی در مغز بعضی از افراد یافت می شوند. آنها به نام کاشف این اجسام نامگذاری شدهاند. اگر کسی را میشناسید که مبتلا به DLB است، این به دلیل رسوب اجسام مذکور در بخشی از مغز است که به آن کورتکس میگویند. بنابر آمار وبسایت سازمان لوییبادی آمریکا، این نوع بیماری حدود ۱۰ درصد کل بیماران دمانس را شامل میشود و تعداد مبتلایان به آن در آمریکا بالغ بر ۱٫۴ میلیون نفر می شود و از نظراین سازمان، دومین نوع دمانس شایع در آمریکا است. آمار مبتلایان به دمانس لوییبادی و دمانس عروقی مغز، بسیار به هم نزدیک است و به همین دلیل در مورد دومین یا سومین نوع شایع دمانس در آمریکا، اتفاق نظر وجود دارد.
این نوع دمانس در سنین سالمندی بیشتر شایع است ولی موارد زیر ۶۰ سالگی نیز وجود دارد. اکثر این بیماران با مشکلات حافظه و تفکر که در آلزایمر هم وجود دارد روبهرو هستند. بافت مغز در مبتلایان به این بیماری نوعی پروتئین غیرطبیعی تولید میکند که به آن نام «لوییبادی یا اجسام لویی» دادهاند. لوییبادی همچنین در مغز مبتلایان به پارکینسون و آلزایمر هم دیده میشود. البته این پروتئین در قسمتهای مختلفی از مغز مبتلایان به این بیماریها دیده میشود.
دمانس لویی بادی توانایی فکر کردن، استدلال و تحلیل اطلاعات را تحتتاثیر قرار میدهد. ممکن است توانایی حرکت، شخصیت و حافظهی فرد هم تحتتاثیر قرار بگیرد. بروز این بیماری با سن و سال ارتباط دارد و معمولا در دههی شصت یا هفتاد زندگی آشکار میشود و با گذشت زمان عوارض فیزیکی و تغییرات رفتاری در آنها بروز میکند. دمانس لوییبادی با چهار خصوصیت اصلی بالینی شناخته میشود. اولین خصوصیت اینکه تغییرات سطح هوشیاری و ذهنی بیمار در طول روز و یا هفته متغیر هستند. بهطوری که بیمار در برخی زمانها کاملا طبیعی و در برخی دیگر کاملا دچار اختلال ذهنی است. دومین خصوصیت این نوع دمانس، وجود توهمات بینایی به صورت دیدن اشخاص و حیوانات است.
بیمار ممکن است در عالم توهم، نزدیکان، اشیا و حیواناتی را که سالها قبل فوت کردهاند، بهوضوح ببیند و حتی با آنها صحبت کند. سومین خصوصیت دمانس لوییبادی وجود علایمی شبیه به بیماری پارکینسون در این بیماران است. به همین دلیل ممکن است برای آنها، به اشتباه تشخیص بیماری پارکینسون داده شود. چهارمین خصوصیت این بیماران، حساسیت زیاد آنها به برخی از داروها خصوصا داروهای ضدروانپریشی است. این بیماران با مصرف دوزهای خیلی کم این داروها ممکن است عوارضی را نشان دهند که معمولا در بقیه بیماران در دوزهای بالا دیده میشود.
دمانس پیشروندهی سریع
بیشتر موارد دمانس، سیری کند و چندین ساله دارند، ولی عوامل بیماریزایی وجود دارد که میتواند بیمار را با تابلوی دمانس، در عرض چند ماه کاملا ناتوان کند. فهرست این بیماریها بسیار گسترده است و شامل عوامل عفونی مانند جنون گاوی و HIV، عوامل متابولیک مانند کمکاری تیرویید و یا کمبود ویتامینها و ریزمغزیها میشود.
علتهای احتمالی بیماری آلزایمر
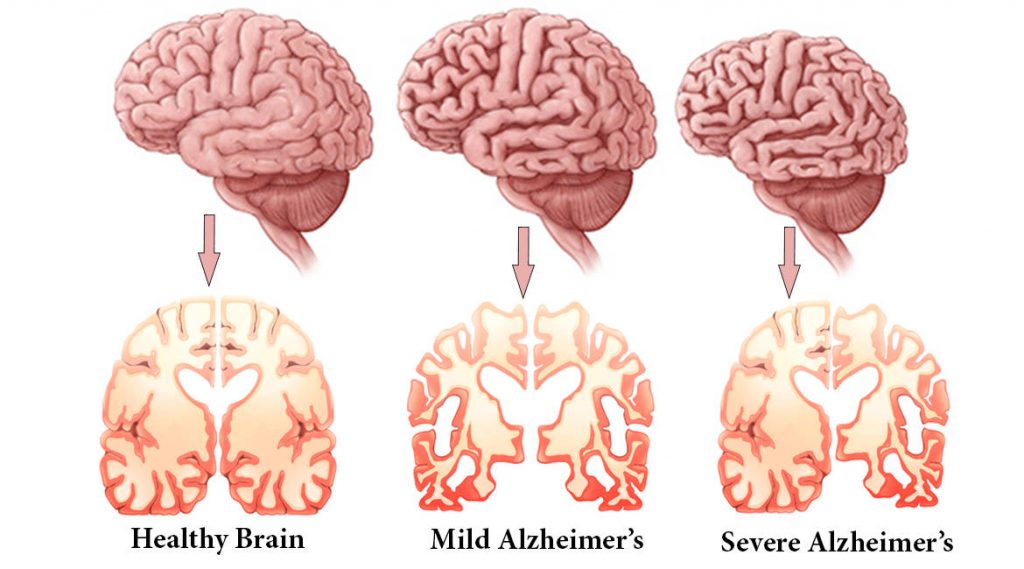
از چپ به راست به ترتیب: مغز سالم، آلزایمر با درجهی متوسط، آلزایمر شدید
پروتئینهای آمیلوئیدوز
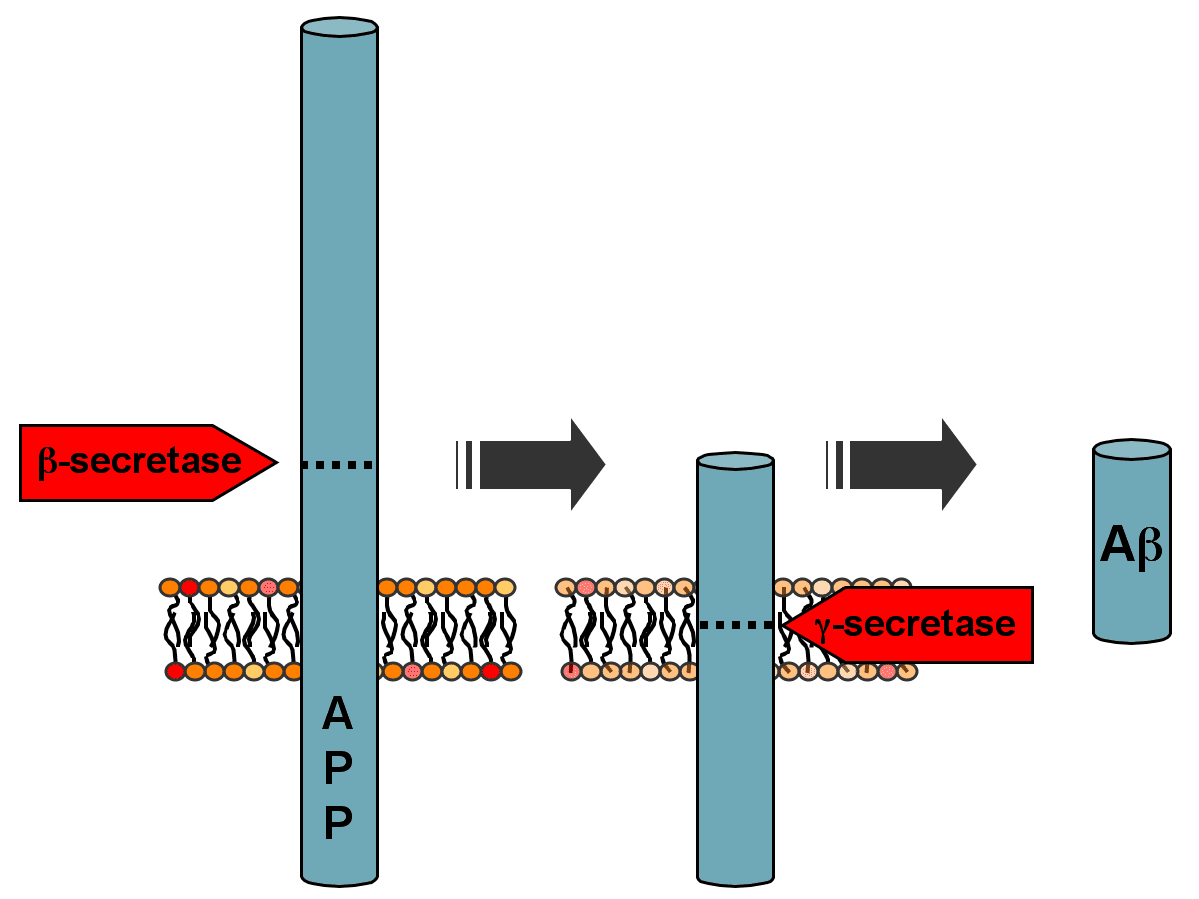
در بیماری آلزایمر، ساختارهای پروتئینی کروی شکلی در خارج یاختههای عصبی برخی مناطق مغز و ساختارهای پروتئینی رشتهای در جسم سلولی نورونها، تشکیل میشود. این ساختارهای پروتئینی که به آنها اجسام آمیلوئیدی گفته میشود در اثر برخی تغییرات در پروتئین سلولهای عصبی و بههم خوردن تعادل و تغییر در میزان یا ساختار پروتئینهای پرسینیلین، آپولیپوپروتئین E، سینوکلئین و پپتید آمیلوئید-بتا ایجاد میشود. یکی از مهمترین پروتئینهایی که در ایجاد آلزایمر نقش دارد پروتئین پیشساز آمیلوئید (APP) نام دارد. این پروتئین در سلولهای دستگاه عصبی موجود است و در اتصال سلولها به همدیگر، تماس سلولها، اتصال به ماتریکس برونیاختهای و اسکلت سلولی نقش دارد. پروتئین APP بهوسیلهی سه نوع آنزیم پروتئولیتیک پردازش میشود. آنزیمهای آلفا، بتا و گاما-سکرتاز، به ترتیب پروتئین APP را در اسیدهای آمینه ۶۷۸، ۶۷۱ و ۷۱۱ برش میدهند.
با اثر آنزیمهای گاما و بتا سکرتاز بر پروتئین APP، بهترتیب، پپتیدهایی به نام آمیلوئید-بتا ۴۰ (دارای ۴۰ اسید آمینه) و آمیلوئید-بتا ۴۲ (دارای ۴۲ اسیدآمینه) ایجاد میشوند. در حالت عادی مقدار این قطعات در سلولها کم است و بهسرعت تجزیه میشود اما اگر در پروتئوم سلولهای عصبی این تعادل بههم بخورد و مقدار این قطعات افزایش یابد، ساختارهای پروتئینی کروی و در نتیجه آلزایمر ایجاد میشود. در بیماران مبتلا به سندروم داون (تریزومی ۲۱) میزان بیان پروتئین APP افزایش مییابد و علائمی شبیه آلزایمر مشاهده میشود که ممکن است به علت افزایش مقدار پپتید آمیلوئید-بتا ۴۲ باشد؛ زیرا ژن پروتئین APP بر روی کروموزوم ۲۱ قرار دارد.
ژنهای E۴ چندگانه
در یک مطالعه مشخص شد که افرادی که یک نسخه از ژن E4 را دارند سه برابر بیش از کسانی که فاقد این ژن هستند دچار بیماری آلزایمر میشوند.
نوروپاتولوژی
مشاهده نورو آناتومیک مغز بیمار مبتلا به آلزایمر با چشم غیرمسلح، پهن شدن شکنجهای قشری و اتساع بطنهای مغز را نشان میدهد. یافتههای میکروسکوپیک کلاسیک نیز از بین رفتن نورونها، وجود پلاکهای پیری و از بین رفتن سیناپسها را نشان میدهد.
پیامرسانهای عصبی
پیامرسانهای عصبی که بیش از همه در بیماری آلزایمر شناخته شدهاند، استیلکولین و نوراپینفرین هستند که ظاهرا هر دوی آنها در بیماران آلزایمری، فعالیت کمتری دارند.
مسمومیت با آلومینیوم
سطح بالای آلومینیوم در مغز برخی از بیماران مبتلا به آلزایمر یافت شده است. اما این موضوع یک عامل بزرگ به حساب نمیآید.
دمانس عروقی
علت اولیهی دمانس عروقی، بیماری عروقی چندگانهی مغزی است که باعث بروز الگوی دمانس میشود. این بیماری در مردها بیشتر است و اکثرا عروق مغزی کوچک و متوسط را گرفتار میکند.
بیماری نیمن پیک
نیمن پیک بیماری نادر و ارثی است که توانایی متابولیزه کردن چربی (کلسترول و لیپیدها) را در داخل سلولها تحت تاثیر قرار میدهد. این سلولها دچار تغییر عملکرد شده و با گذشت زمان از بین میروند. بیماری نیمن پیک میتواند مغز، اعصاب، کبد، طحال، مغز استخوان و در موارد شدید ریهها را تحت تأثیر قرار دهد.. همچنین بیماری جسم لویی، بیماری هانتینگتون و بیماری پارکینسون میتواند منجر به دمانس شود.
پاتولوژی بیماری آلزایمر
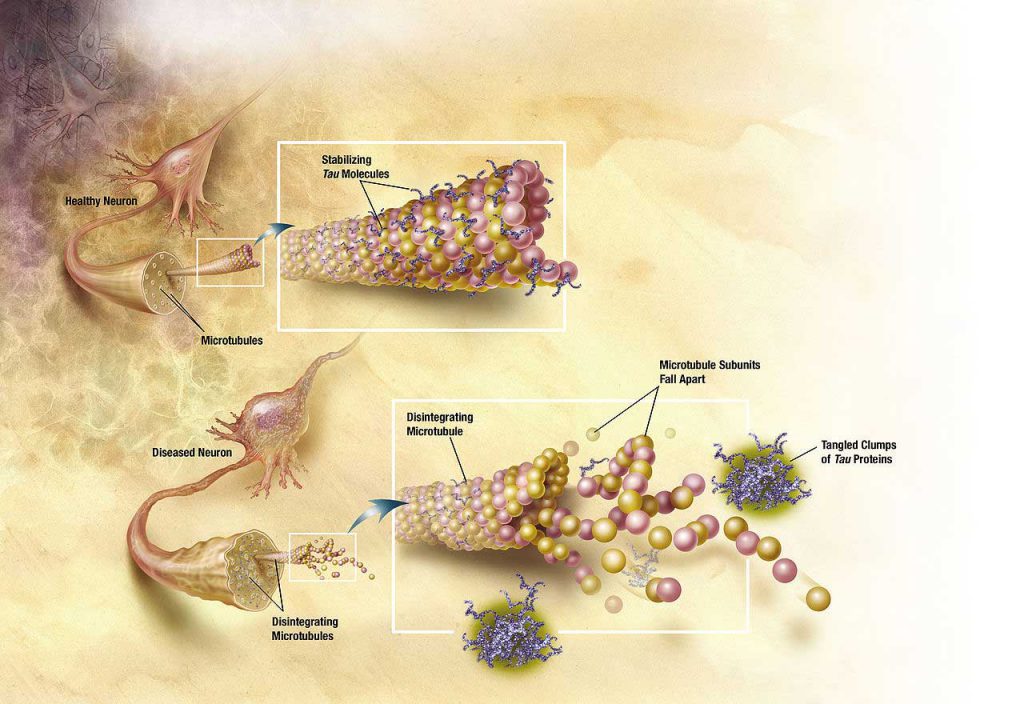
در بیماری آلزایمر تغییرات پروتیئن تائو باعث تجزیهی میکروتوبولهای سلولهای مغزی میشود.
دو دهه پیش از اینکه بیماری آلزایمر بخواهد خود را نشان دهد، مغز فرد تغییرات را آهسته و آرام آغاز میکند. بزرگترین اتفاق در میان این تغییرات، ایجاد تودههایی به نام پلاکهای آمیلوئیدی در بخش بیرونی سلولهای مغزی و شکلگیری رشتههای پروتئینی درون سلولهای عصبی است که به آنها “NFT” میگویند. این تغییرات خصوصا در بخش یادگیری و حافظهی مغز رخ میدهند. موارد بسیاری است که در مورد رشتهها و پلاکها نمیدانیم اما دانشمندان تقریبا مطمئن هستند که این دو نقش مهمی در آلزایمر و ایجاد مشکل در فعالیتهای مغزی ایفا میکنند. چه تودههای تشکیلشده از آمیلوئید-بتا و چه این رشتههای پروتئینی، هر دو سبب اختلال در ارسال پیام از یک نورون به نورون دیگر و در نتیجه فعالیت صحیح و سالم مغز میشوند.
NFTها رشتههای گرهداری هستند که به احتمال فراوان در طولانی مدت سبب مرگ سلول میشوند. بهطور معمول، در مغز انسان مواد غذایی از کانالهای موازی و مستقیمی میگذرند. رشتهها مانع انتقال صحیح مواد غذایی میشوند و جلوی راه می ایستند، بنابراین سلولهای دیگری که نیازمند سوخت هستند از بین میروند. هر چه که آلزایمر پیشرفت کند، سلولهای مغزی بیشتر و بیشتر از بین میروند و سطح نوروترانسمیترها یا انتقالدهندههای عصبی نیز کاهش مییابد. انتقالدهندههای عصبی موادی هستند که اطلاعات را از هر نقطهی بدن به مغز میرسانند. همزمان، مغز شروع به التهاب میکند، اما پزشکان نمیدانند که این التهاب نقشی موثر در نابودی پلاکها و رشتهها دارد یا خیر. این احتمال دارد که التهاب مغز بهدلیل حملهی همهجانبهی سیستم ایمنی بدن به NFTها باشد.
یکی از نشانههای ثبتشدهی آلزایمر، پلاکهای چسبندهی پروتئین آمیلوئید-بتا است، که در اطراف سلولهای عصبی تشکیل میشوند. اغلب دانشمندان بر این باورند که آمیلوئیدها مسئول فروپاشی پردازش اطلاعات و مرگ سلولها هستند. با این حال، بیش از یک دهه است که پژوهشگران به پروتئین دیگری به نام تاو، که در داخل سلولهای مغز یافت میشود، بهعنوان عامل اصلی اشاره میکنند. مطالعهی جدیدی با تصویربرداری از مغز ۱۰ نفر با آلزایمر خفیف نشان داده است، رسوب تاو، نه آمیلوئید، به علائمی مانند از دست دادن حافظه و زوالعقل بسیار مرتبط است. اگر چه این شواهد نمیتواند بحث آمیلوئید-تاو را حل و فصل کند، اما میتواند پژوهشگران را به پژوهشهای جدید و بیشتر جهت درمان با هدفگیری تاو و ابزارهای تشخیصی بهتر راهنمایی کند.
پروتئین تاو، در بدن در تنظیم رشد نورونها، انتقال سیگنال نورونی و فعالیت اعضای سیتواسکلت بهنام میکروتوبولها نقش دارد. اما تاو در مغز افراد مبتلا به آلزایمر دچار تاخوردگیهای اشتباهی شده است که منجر به ایجاد تجمعات غیرعادی در مغز به نام تنگلهای نوروفیبریلاری میشود. مدتها است که دانشمندان از یک تکنیک تصویربرداری به نام برشنگاری با گسیل پوزیترون (PET) جهت مشاهدهی رسوب آمیلوئید بتای نشاندارشده با برچسبهای شیمیایی رادیواکتیو، در مغز افراد مبتلا به آلزایمر استفاده میکنند. در کنار بررسیهای مرگ بافت مغزی، این مطالعات نشان دادهاند که افراد مبتلا به آلزایمر، به مراتب پلاک آمیلوئیدی بیشتری در مغز خود نسبت به افراد سالم دارند.
مسئله اینجا است که حدود ۳۰ درصد از مردم بدون هیچ نشانهای از زوال عقل مغز، در کالبد شکافی دارای مغز غنی از آمیلوئید هستند. بنابراین این سوال مطرح شده است که شاید پروتئین تاو با پیچخوردگی ساختاری اشتباه، عامل اصلی تخریب نورونها و بروز علائم بیماری بوده یا حداقل یک عامل مهم است. تا همین اواخر، تنها راه برای آزمایش این فرضیه، اندازهگیری تاو در بافت مغز پس از مرگ فرد، یا نمونههای مایع مغزی نخاعی (CSF) فرد در طول حیاتش بود. اما در چند سال گذشته، پژوهشگران تصویربرداری PET را طوری توسعه دادهاند که بدون هیچ خطری میتوان به مقدار تاو در مغز فرد زنده دسترسی داشت. در مطالعهای جدید، پژوهشگران یکی از این برچسبها و یکی از برچسبهای متصلشونده به آمیلوئید را استفاده کردهاند تا بتوانند رسوب هر دو پروتئین را در ۱۰ نفر با آلزایمر خفیف و ۳۶ بزرگسال سالم بررسی کنند.
رسوب تاو بیشتر در لوب گیجگاهی یافت شد، جایی که در مغز در ارتباط با حافظه بوده و مربوط به اختلالات بیشتری در گروههای آزمایش حافظه است. این گزارش در Science Translational Medicine منتشر شده است. همین رابطه در مورد آمیلوئید بتا صدق نمیکند. هرچند که اسکن PET از آمیلوئید-بتا میتواند منجر به تشخیص زود هنگام آلزایمر شود، اما زمانی که فرد در حال عبور از مراحل اولیه و بدون نشانهی بیماری به مرحلهی خفیف آلزایمر است، تاو پیشبینی کنندهی بهتری است. همچنین، مغز ممکن است قادر به جبران صدمههای حاصل از آمیلوئید-بتا باشد، اما زمانی که تاو شروع به پخش شدن میکند، بدن قدرت مقابله با آن را ندارد.
پژوهشگران دریافتهاند مقادیر بالای تاو که در CSF بیماران یافت میشود، ارتباط مستقیمی با افزایش تاو در لوب گیجگاهی مغز دارد؛ منطقهای در مغز که در پردازش حافظه نقش دارد. بنابراین میتوان از تاو در مایع مغزی نخاعی بهعنوان یک ابزار تشخیصی استفاده کرد. البته این مطالعه فقط براساس یک نقطهی زمانی در مغز شرکتکنندگان بوده است، پس نمیتواند ارتباط بین افزایش تاو و زوال ذهنی را اثبات کند. در حال حاضر مطالعات ردیابی تاو و آمیلوئید مغز افراد در طول زمان در جریان است. هدف اصلی این مطالعات این است که پژوهشگران براساس آنچه که در مغز اتفاق میافتد، قادر به پیشبینی این باشند که کدام درمان آلزایمر مورد نیاز هر فرد است.
نقش ژنتیک در آلزایمر
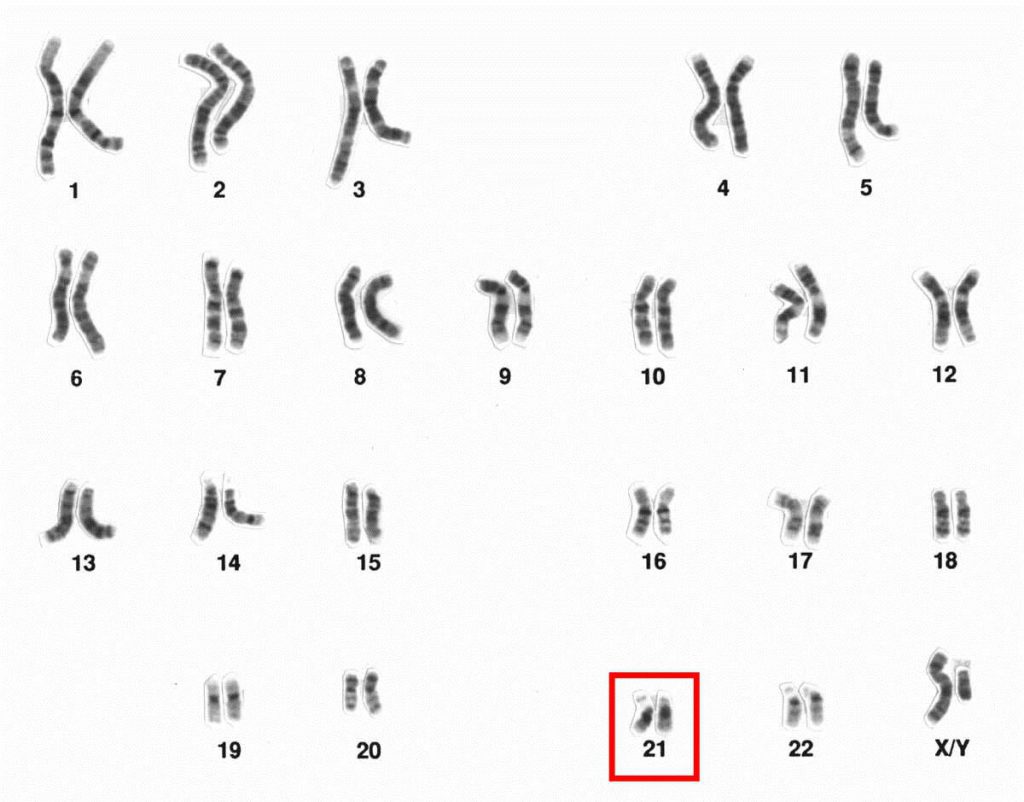
ژن پروتئین APP روی کروموزوم 21 قرار دارد
متاسفانه پژوهشها نشان دادهاند، کسانی که یکی از بستگان درجه یکشان مبتلا به آلزایمر است، شانس بیشتری برای ابتلا به آلزایمر دارند. اگر پدر یا مادر شما آلزایمر زودرس دارند، و شما جهش ژنی مربوط به آن را بهارث برده باشید، دیگر نمیتوانید از ابتلا به بیماری جلوگیری کنید. ژنهای مخصوصی وجود دارند که روی احتمال ابتلا به بیماری تاثیرگذار، یا تعیین کنندهاند. ژنهای تعیینکننده، ژنهایی هستند که مستقیما باعث بهوجود آمدن بیماری میشوند و اگر فردی حامل این ژنها باشد مطمئنا به بیماری مربوط به آن مبتلا خواهد شد. مانند ژنی که آلزایمر زودرس را بهوجود میآورد. ژنهایی نیز وجود دارند که احتمال ابتلا به بیماری را افزایش میدهند اما صددرصد باعث ابتلا به بیماری نمیشوند. APOE-e4 یکی از این ژنها است که در ۲۰ تا ۲۵ درصد از افراد مبتلا به آلزایمر وجود دارد.
بیماری آلزایمر یک بیماری پیچیدهی چندعاملی است. حدود ۱۰ در صد موارد آن بهصورت ارثی با توارث اتوزومال غالب (AD) است. در بیماری آلزایمر ارثی (FAD)، بیماری آلزایمر، بهصورت زودرس بین سنین ۵۵ الی ۶۵ بروز میکند. از حدود ۹۰ درصد موارد بیماری که بهشکل اسپورادیک (Sporadic) است، ۲۵ تا ۴۰ درصد آنها با برخی آللهای ژنها ارتباط دارند. با بررسی ژن APP در اعضای خانوادههایی که افراد آن مبتلا به نوع زودرس آلزایمر میشدند، جهشهای مختلفی در این ژن یافت شد که در ژن APP افراد سالم وجود نداشت. بیشتر این جهشها، جهشهای بدمعنی در اسید آمینههای ۷۱۶ و ۷۱۷ بودند. همچنین دو جهش همزمان در اسید آمینههای ۶۷۱ و ۶۷۰ در موارد زیادی مشاهده شد.
در اثر جهش در جایگاههای ۷۱۶ یا ۷۱۷ فعالیت آنزیمهای β و γ-سکرتاز تغییر میکند و میزان تولید Aβ۱–42/43) افزایش مییابد. همچنین جهشهای همزمان در جایگاه ۶۷۱ و ۶۷۰ باعث افزایش فعالیت β-سکرتاز و افزایش میزان Aβ۱–۴2(43) میشود. با انجام آنالیز پیوستگی بر روی اعضای خانوادههای مبتلا به نوع زودرس آلزایمر، ناحیهای بر روی کروموزوم 14 (14q24.3) در ارتباط با آلزایمر بهدست آمد. mRNAهای مختلف حاصل از این ناحیه با تکنینک “RT-PCR” بررسی شد و با مقایسهی موتاسیونهای موجود در mRNA افراد بیمار با افراد سالم، ژن عامل آلزایمر شناسایی شد. این ژن پروتئینی کد میکرد که پرسینیلین ۱ نام گرفت؛ این ژن با “PSEN1” نمایش داده میشود.
با همین روش یک ژن مشابه دیگر، برروی کروموزوم ۱ در ناحیه 1q32-42 شناسایی شد که “PSEN2” نام گرفت. پروتئینهای پرسینیلین ۱ و ۲، حدود ۶۷ درصد با هم شباهت دارند و پروتئینهای غشایی هستند. حدود ۴۰ درصد از آلزایمرهای زودرس فامیلی بهعلت جهش در این ژن است؛ جهش در این ژن باعث افزایش مقدار Aβ۱–42(43) میشود (مکانیسم این عمل هنوز مشخص نیست). با استفاده از آنالیز پیوستگی، ژنهای دیگری نیز در ارتباط با آلزایمر دیرهنگام فامیلی شناسایی شده است. یکی از این جایگاهها، برروی کروموزوم ۱۹ در ناحیه 19q13.2 قرار دارد که در آن ژن APOE، که آپولیپوپروتیئن E را کد میکند. این ژن دارای سه آلل است که با بررسیهای بیشتر مشخص شد آلل APOE-e4 با بیماری آلزایمر ارتباط دارد. البته وجود این آلل بهصورت هموزیگوت یا هتروزیگوت در یک فرد، حتما با بروز آلزایمر همراه نیست و این آلل فقط شانس ابتلای فرد به آلزایمر را افزایش میدهد.
ساختار سهبعدی پروتئین APP
این آلل بهعنوان یک فاکتور خطر، برای آلزایمر بهحساب میآید؛ عوامل دیگری مانند عوامل محیطی و فیزیولوژیکی علاوه بر آلل APOE-e4، برای بروز آلزایمر لازم است (مولتی فاکتوریال). علاوه بر این آلل، آللهایی از ژنهای A2M که بر روی کروموزوم ۱۲ در ناحیه 12p13.3 و LRP1 که بر روی کروموزوم ۱۲ در ناحیه 12q13-14 قرار دارد، بهعنوان فاکتورهای خطر بیماری آلزایمرمحسوب میشوند. این دوژن به ترتیب پروتئینهای آلفا-۲-ماکروگلوبولین (A2M) و پروتئین وابسته به رسپتور LDL1، (LRP1) را کد میکنند.LRP1 به A2M ،APP و APOE متصل میشود و تجزیهی APP را تسهیل میکند. در صورت جهش در این دو پروتئین، عمل تجزیهی APP بهراحتی صورت نمیگیرد و در اثر بههم خوردن تعادل، میزان پروتئینهای آمیلوئیدوژن، افزایش مییابد.
تشخیص بیماری آلزایمر
یکی از مشکلات تشخیص بیماری آلزایمر آن است که روش قابل اندازهگیری و دقیقی برای اندازهگیری این پروتئینها که در مراحل اولیه بیماری شروع به افزایش میکنند، وجود ندارد. درحقیقت ما فقط پس از مرگ بیمار و با آزمایش بافت مغزی او میتوانیم بهطور قطع آلزایمر را تشخیص دهیم. در حال حاضر، هیچ آزمایشی برای تعیین این که آیا یک فرد آلزایمر دارد یا در معرض خطر این بیماری است، وجود ندارد. تشخیص آلزایمر نیاز به ارزیابیهای دقیق پزشکی، از جمله معاینات فیزیکی و عصبی و آزمایش وضعیت روانی دارد. در حالی که هیچ راهی برای مقابله با پیشرفت بیماری آلزایمر یا از بین بردن این بیماری وجود ندارد، تشخیص زود هنگام میتواند احتمال تاثیرگذاری داروهای درمانی را افزایش دهد.
تشخیص با نانوحفرهها
پژوهشگران با عبور دادن پروتئینها از نانوحفرهها موفق به کسب اطلاعاتی در مورد ساختار آنها شدهاند. با توجه به این که عبور پروتئینهای متفاوت اثرات مختلفی از خود بر جای میگذارد، میتوان از این روش در تشخیص سریع بیماریها نیز استفاده کرد. پژوهشگران دانشگاه پنسیلوانیا گامهای بلندی به سوی دستیابی به روشی برای تشخیص ترتیب پایههای DNA وقتی که از یک حفره نانومقیاس عبور میکنند، برداشتهاند. همچنین، در این مطالعه آنها متوجه شدهاند که می توان این روش را برای کسب اطلاعات بیشتر در مورد ساختار پروتئینها نیز استفاده کرد. روشهایی که در حال حاضر برای این امر وجود دارند، نیازمند کار بسیار زیاد و استفاده از تعداد بسیار زیادی پروتئین هستند. همچنین باید تغییراتی روی پروتئین اعمال شود که کارایی این مدلها را برای درک رفتار پروتئینها در حالت طبیعی و واقعی آنها محدود میسازد
روش جابهجایی (Translocation) که توسط پژوهشگران دانشگاه پنسیلوانیا معرفی شده است، امکان مطالعه روی پروتئینهای منفرد را بدون اصلاح آنها فراهم میکند. در این روش با بررسی نمونههای منفرد، امکان تشخیص بیماریها و پژوهش روی آنها فراهم میشود. این روش از تشخیص ترتیب ژنها به کمک نانوحفرهها نشات میگیرد که هدف آن تشخیص پایهها (آدنین، تیامین، گوانین، سیتوزین) در رشتهای از DNA، از طریق بررسی اندازه روزنهای است که آنها هنگام عبور از حفره نانومقیاس میپوشانند. اثرات متفاوت بر جایمانده از این عبور به مقادیر متفاوتی از مایعات یونی اجازه عبور میدهد. تغییرات جریان یونها توسط ادوات الکترونیکی اطراف حفره اندازهگیری میشود و میتوان فراز و فرودهای این سیگنال را با هر کدام از پایهها مرتبط دانست.
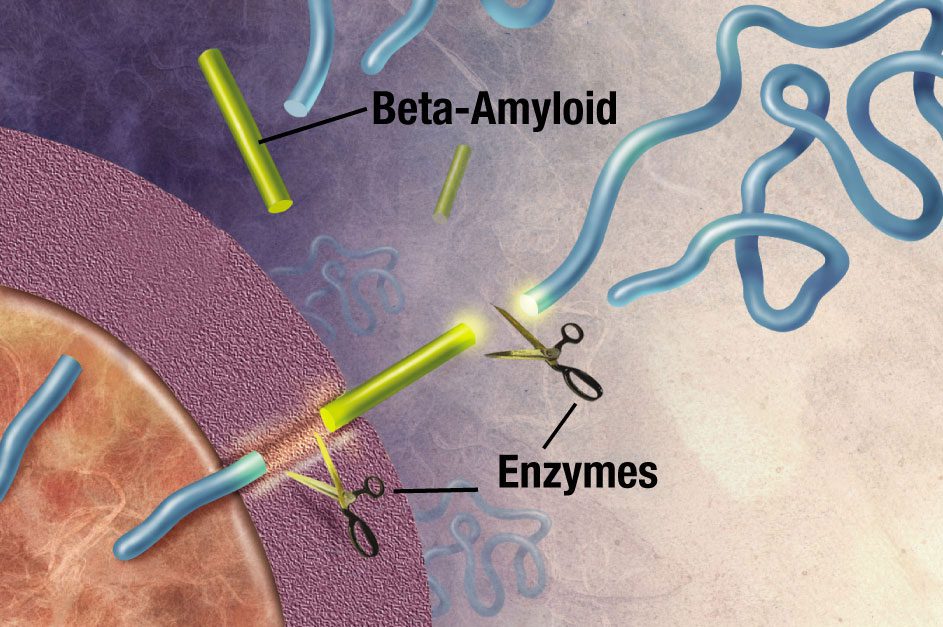
آنزیمی، مولکول APP را به قطعات کوچک برش میدهد. قطعات آمیلوئید-بتا در تشکیل پلاکهای پیر آلزایمر نقش حیاتی دارد.
درندیک و همکارانش با انجام آزمایشهایی، اثرات این روش روی سایر مولکولهای زیستی و ساختارهای نانومقیاس را بررسی کردند. با همکاری گروه ساون، آنها روی مولکولهایی که نیاز به دقت بیشتری داشت، آزمایشهایی را صورت دادند. ساون در این مورد میگوید:
پروتئینهای بسیاری وجود دارند که ما دوست داریم آنها را نیز مطالعه کنیم؛ پروتئینهایی که بسیار کوچکتر از رشتههای DNA هستند و کارکردن روی آنها بسیار دشوار است. ما علاقهمند هستیم اطلاعات زیادی در مورد ساختار یک پروتئین داشته باشیم مانند این که آیا به صورت مونومر وجود دارد یا با یک پروتئین دیگر ترکیب شده و به صورت دیمر است یا اجتماعی از تعداد زیادی از پروتئینها است و به صورت الیگومر وجود دارد.
پژوهشگران نسبتهای مختلفی از مونومر و دیمر را در یک سیال یونی ریختند و از حفرهها عبور دادند. مونومرها و دیمرها تعداد متفاوتی از یونها را مسدود میکنند. بنابراین وقتی از حفره میگذرند، جریانهای متفاوتی مشاهده میشود. بسیاری از پژوهشگران مارپیچهای طولانی از پپتیدها (گروهی از آمینواسیدها) و پروتئینها را در بیماریهایی مانند آلزایمر و پارکینسون مشاهده کردهاند اما مدارک بسیاری موجود است، که نشان میدهد این مارپیچها به بعد از بیماری مربوط میشوند و عامل اصلی که باعث بیماری میشود، مجموعهای از پروتئینهای کوچکتر هستند. اما تشخیص ماهیت و اندازهی این مجموعهها در شرایط فعلی بسیار دشوار است.
نشانگر ژنی
دانشمندان دانشگاه «کینگز کالج» لندن نوعی نشانگر ژنی ارائه دادهاند که میتوان از آن برای پیشبینی شروع بیماریهایی مانند آلزایمر، پیش از ظهور آن استفاده کرد. این پژوهش به دنبال تعریف مجموعهای از ژنهای مرتبط با پیری سالم در سن ۶۵ سالگی است. چنین پروفایل مولکولی میتواند برای تشخیص دادن افراد در معرض خطر زود هنگام بیماریهای مرتبط با سن کارآمد باشد. این موفقیت نخستین نشانگر مولکولی قوی سن بیولوژیکی را در انسانها، ارائه داده است و میتواند شیوهی استفاده از سن، برای تصمیمات پزشکی را متحول سازد.
این امر شامل شناسایی افرادی است که به احتمال زیاد در معرض خطر بیماری آلزایمر هستند. پژوهشگران RNAی متعلق به سوژههای ۶۵ ساله را تحلیل کردند و از اطلاعات بهدست آمده برای تولید نشانگری متشکل از ۱۵۰ ژن RNA استفاده کردند که پیری سالم را نشان میدهند. این نشانگر، پیشبینیکنندهی قابل اعتمادی برای خطر بیماری مرتبط با سن هنگام مطالعه آرانای از بافتهایی مانند عضلهی انسانی، مغز و پوست است. دانشمندان با استفاده از این نشانگر آرانای، نمرهی ژنی سن سالمی تولید و برای آزمایش کردن و مقایسه کردن پروفایلهای آرآنای افراد مختلف از آن استفاده کردهاند.
آزمایش بزاق
بسیاری از روشهای تشخیصی برای آلزایمر میتواند تهاجمی و پرهزینه باشد و این انگیزه را برای جستجوی روشهای سادهتر و ارزانتر تقویت میکند. به همین دلیل، پژوهشگران دانشگاه «آلبرتا» در کانادا با استفاده از طیفسنجی جرمی کروماتوگرافی مایع (LCMS) به تجزیه و تحلیل نمونه بزاق ۲۲ بیمار آلزایمری، ۲۵ بیمار مبتلا به اختلال شناختی خفیف (MCI) و ۳۵ بیمار با عملکرد نرمال شناختی پرداختند. این پژوهشگران ترکیباتی را شناسایی کردهاند که در بزاق بیماران مبتلا به آلزایمر و MCI بارزتر بود و آنها را از افراد سالم متمایز میکرد. بررسیهای بیشتر نشان داد که سطوح بالاتری از مواد خاص در بزاق شرکتکنندگان با عملکرد شناختی ضعیفتر ارتباط نزدیکی دارد. به عنوان مثال، سطح بالاتر یک ترکیب خاص در بزاق شرکتکنندگان مبتلا به آلزایمر مرتبط با سرعت کندتر پردازش اطلاعات بود. این تیم، معتقد است یافتههای آنها نویدبخش روشهای تشخیصی غیرتهاجمیتر و ارزانتر برای آلزایمر است.
آزمون بیومارکر
بیومارکر چیزی است که در صورت اندازهگیری میتواند بیماری را تشخیص دهد. دو پروتئین، آمیلوئید-بتا و تائو که در مغز افراد مبتلا به آلزایمر یافت میشوند، میتوانند در مایعی که مغز و نخاع را احاطه کرده است (مایع مغزی-نخاعی) اندازهگیری شوند. این مایع برای نشان دادن پیشرفت غیرطبیعی پروتئینهای آمیلوئید-بتا، که پلاکها را تشکیل میدهند، و پروتئینهای تاو که رشتههایی را تشکیل میدهند، استفاده میشوند. این پروتئینها میتوانند بیماری آلزایمر را از دلایل دیگر زوال عقل تشخیص دهند و ممکن است به شناسایی افراد مبتلا به این بیماری، قبل از تنزل شدید روانی کمک کنند. آنها میتوانند تشخیص آلزایمر را پشتیبانی کنند، اما هنوز بهطور روتین برای تشخیص استفاده نشدهاند.
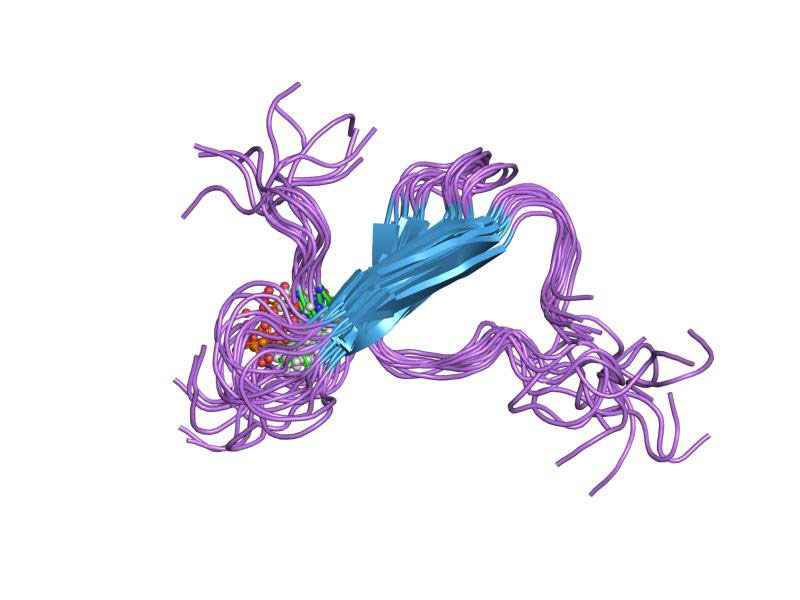
ساختار سهبعدی پروتئین تائو: پروتئینهای تائو که کارکرد خود را در تثبیت کردن ریزلولهها از دست دادهاند عامل اصلی بیماریهای مرتبط با زوالعقل مانند آلزایمر و پارکینسون هستند.
تصویربرداری مغز (تصویربرداری عصبی)
پژوهشگران در حال مطالعهی تکنیکهای تصویربرداری، مانند MRI و برشنگاری با گسیل پوزیترون استفاده شده با ردیاب رادیویی (رادیوتراکر) هستند. رادیوتراکرها ذرات شارژ شده هستند که مناطق آلوده را در تصاویر مغز درخشان میکنند و نشان میدهند؛ بهعنوان مثال، با اتصال به پروتئینهای همراه آلزایمر، آمیلوئید و تاو. با این حال، داشتن پلاک آمیلوئید در مغز به این معنی نیست که شما دچار زوال عقل هستید.
تست خون
این تست افرادی را که مغزشان مقادیر بالایی آمیلوئید-بتا دارد شناسایی میکند. پژوهشگران امیدوارند که سازمانهای توسعهدهندهی دارو بتوانند از طریق این تست افراد در معرض آلزایمر را قبل از وارد شدن آسیبهای جدی به مغزشان جذب کنند و آزمایشات بالینی را بر روی آنها انجام دهند در اینصورت نتیجهی آزمایشها نیز قابل اعتمادتر خواهد بود. تا به امروز تنها راه برای بررسی میزان آمیلوئید-بتا در مغز (بدون کالبد شکافی) روش برشنگاری با گسیل پوزیترون بود، همچنین تعیین میزان پروتئینها بهطور مستقیم از مایع مغزی-نخاعی ناحیه نخاع صورت میگرفت. با اینکه هر دو این روشها موثر بودند اما هم هزینهبر و هم انجام دادنشان دشوار بود.
برای اندازهگیری میزان تکههای آمیلوئید-بتا در یک نمونهی خون و یا میزان پروتئین بزرگتری که تکههای آمیلوئید-بتا از آن منشا میگرفتند، دکتر یانگیساوا و همکارانش دو روش را باهم ترکیب کردند: ایمونو پروسیپیتیشن و طیفسنجی جرمی. یافتههای آنان با یافتههای بهدستآمده از تصویرنگاری مغز و آنالیز مایع مغزی-نخاعی در ۱۲۱ نفر از مردم ژاپن و ۲۵۲ نفر از مردم استرالیا تطابق کامل داشت. این افراد اکثرا ۶۰ الی ۹۰ ساله بودند. برخی از این افراد سالم بودند، برخی اختلالات خفیف در مهارتهای شناختی از خودشان نشان دادند و برخی نیز مبتلا به آلزایمر معرفی شدند.
درمان
بیش از ۶ میلیون آمریکایی از بیماری آلزایمر یا زوال عقل رنج میبرند. حتی با افزایش میانگین سن جمعیت انتظار میرود که این تعداد بهطور چشمگیری افزایش یابد. دههها، پزشکان سرتاسر جهان به دنبال راههایی برای تقویت مغز و جلوگیری از آلزایمر در دوران پیری بودهاند. محققان طیف گستردهای از درمانهای مختلف از جمله ورزش، بازیهای مغزی و دارودرمانی را امتحان کردهاند. مطالعات سیستماتیکی که مدتی پیش دربارهی شواهد پیشگیری و درمان آلزایمر چاپ شده است، خبرهای خوبی به همراه ندارد. در ۲۵ سال گذشته، تمرکز درمان بر روی فرضیهی آبشار آمیلوئید استوار بود. در این فرضیه گفته میشود که ایجاد پلاکهایی از پپتیدهای آمیلوئید-بتا (Aβ) در مغز باعث مرگ نورونها و اختلال شناختی میشود.
هرچند مستندات ارتباط بیماری آلزایمر و این پلاکها، در جهت هدف قرار دادن پپتید و برگرداندن زوال شناختی بینتیجه بود. پژوهشگران در مقالهای مروری که در مجلهی نیچر چاپ شده است، مطرح کردهاند که علاوهبر اینکه افزایش پلاکهای Aβ ممکن است آغازگر پدیدههای متوالی منجر به بیماری باشد، اما مجموعهی پیچیدهای از تغییرات در سطح سلولی مولکولی، مدار و در سطح شبکه وجود دارد که در پیشرفت آلزایمر نقش دارند. مهمتر اینکه این تغییرات به سادگی با کنترل سطح Aβ برگشتپذیر نیستند. نشان داده شده است که با هدفگیری اختصاصی سیستم انتقالدهندههای عصبی در مغز، مقدار کمی بهبودی حاصل میشود؛ درواقع این امر باعث تغییر فعالیت شبکه و مدار مغزی شده است و قابلیت کاهش و رفع بیماری زوال شناختی را دارد.
فعالیت آنزیمهای β و γ-سکرتاز
همچنین مطالعات انسانی در مقیاس کم نیز نشان داده است که تحریک عمقی مغز، در بهبود شناخت اثرات امیدوارکنندهای داشته است. بررسی دقیق مناطقی از مغز که توسط پلاکهای Aβ آسیب میبینند و سایر آسیبهایی که در پیشرفت آلزایمر نقش دارند، ممکن است به پژوهشگران در شناخت نشانههای اولیهی پیشرفت بیماری کمک کند. به این ترتیب با هدف قرار دادن منشا آسیب، و کاهش زودهنگام سطح Aβ، پژوهشگران میتوانند مدارهای اختصاصی یا نواحی مغزی را هدف قرار بدهند و امید به بهبود عملکرد شناختی داشته باشند. همچنین این امر به متخصصین بالینی اجازه میدهد که افراد با ریسک بالای ابتلا به آلزایمر را قبل از بروز علایم زوال شناختی شناسایی و از پیشرفت بیماری پیشگیری کنند.
دارو درمانی
اگر زوال عقل از عواملی مانند ضربه، اثرات جانبی داروها و کمبود ویتامین ناشی شده باشد، ممکن است بتوان از آسیبهای واردشده به مغز یا گسترش آسیبها به بافت مغز، جلوگیری کرد. علائم بیماری آلزایمر را میتوان به کمک بعضی از داروها کاهش داد. چهار داروی تاییدشده در ایالات متحده بهنام مهارکنندههای کولیناستراز (استیل کولیناستراز) وجود دارند: دونپزیل، گالانتامین، ریواستیگمین و تاکرین. دستهی دیگری از داروها ممانتین نام دارند و بر ضد گیرندههای NMDA مغز عمل میکنند. ممکن است این داروها بهتنهایی یا همراه با مهارکنندههای کولیناستراز مورد استفاده قرار بگیرند. مهارکنندههای کولیناستراز میتوانند به بهبود ویژگیهای رفتاری فرد مبتلا به بیماری پارکینسون نیز کمک کنند.
به یاد داشته باشید هیچگاه این داروها را بهطور خودسر مصرف نکنید و قبل از مصرف هر نوع دارویی، حتما با پزشک خود مشورت کنید. پژوهشگران موسسهی میکروبیولوژی انسانی (HMI) و آزمایشگاههای تتز، هزاران دامنهی شبهپریونی را در ویروسهای انسانی کشف کردهاند که اهداف جدیدی را برای تولید داروهای ضدویروسی جدید فراهم کردهاند. پریونها پروتئینهایی مسری هستند که به دلیل دارا بودن ساختمان غنی از صفحات β میتوانند به صورت خودبهخودی تکثیر شوند که این امر منجر به تجمع پروتئینهای با تاخوردگی شتباه و اثرات نوروتوکسینی در مغز میشود و به سبب پیامدهای نورودژنریتیوی که به دنبال دارند، شناخته شده هستند. با اینحال علت تشکیل پریونهای انسانی هنوز بهطور قطع مشخص نشده است.

کشف پریونها در پروتئینهای ویروسی مسیر ناشناختهای را برای ایجاد بیماریهای مرتبط با پروتئینهای با تاخوردگی غلط از جمله بیماریهای آلزایمر و پارکینسون، آتاکسیا و اسکلروز جانبی آمیوتروفیک آشکار میکند. پژوهشهای پیشین نشان دادهاند که ویروسها در توسعهی بیماریهای یادشده نقش دارند. یافتههای پژوهشگران HMI، برای اولینبار نشان میدهد که تاخوردگی اشتباه پروتئینها، همان مسیر ناشناختهی این پریونها برای آلودهسازی انسان است. کیسی مگوایر، استادیار نورولوژی بیمارستان عمومی ماساچوست کشف دامنههای شبهپریونی در ساختارهای ویروسی را کشف مهمی در زمینه ویروسشناسی میداند. او میگوید:
آنچه این محققین یافتهاند اهداف جدیدی هستند که میتوانند برای تولید داروهای ضدویروسی جدید استفاده شوند که این امر خود میتواند پیامدهای بزرگی در چگونگی درمان و مبارزهی ما با کل بیماریها داشته باشد.
سلولدرمانی
مطالعه جدید نشان میدهد که کاشت نوع خاصی از نورون در داخل مغز ممکن است عملکردهای شناختی در بیماران با تشخیص آلزایمر را بازیابی کند. مغز همانند یک ارکستر بزرگ برای عملکرد مناسب، متکی به هماهنگی کامل بسیاری از عناصر است که اگر یکی از آنها از این هماهنگی خارج شود بر روی کل مجموعه تاثیر میگذارد. در بیماری آلزایمر، برای مثال، آسیب به نورونهای خاصی میتواند ریتم امواج مغزی را تغییر بدهد و سبب ازدست رفتن عملکردهای شناختی شود. محققان موسسات گلادستون در ایالاتمتحده اظهار کردند که نوعی نورون به نام اینترنورون مهاری مخصوصا برای کنترل ریتمهای مغزی حائز اهمیت است.
در این مطالعه، دانشمندان فواید درمانی و بهبوددهندهی این اینترنورونها و کاشت آنها در داخل مغز یک مدل موش آلزایمری را کشف کردند. اینترنورونها شبکههای پیچیدهی بین نورونها را کنترل میکنند و به آنها اجازه ارسال سیگنال به یکدیگر به صورت هماهنگ را میدهند. اینترنورونها ریتمهای مغزی را خلق میکنند تا نورونهای تحریکی را چه در زمان فعالیت و چه در زمان استراحت هدایت کنند. عدم تعادل بین این نوع از نورونها باعث ایجاد اختلال میشود و در بسیاری از اختلالات عصبی و روانی مانند بیماری آلزایمر، صرع، اسکیزوفرنی و اوتیسم دیده میشود. جورج پالوپ از موسسه گلادستون میگوید:
این اینترنورونهای پیوندشده میتوانند بهخوبی در داخل بافتهای جدید مغز گنجانده شوند و هر اینترنورون نیز قادر به کنترل هزاران نورون تحریکی خواهد بود. این ویژگیها، اینترنورونها را به یک هدف درمانی امیدبخش برای اختلالات شناختی مرتبط با ناهنجاریهای ریتم مغز و فعالیت صرعی تبدیل میکند.
در ابتدا، دانشمندان باید به یک چالش مهم غلبه میکردند، زیرا زمانیکه اینترنورونهای منظم را پیوند زدند، هیچ تاثیر مثبتی مشاهده نکردند. احتمالا به این دلیل که بیماری آلزایمر یک محیط سمی در داخل مغز ایجاد میکند. محققان پس از آن بهطور ژنتیکی فعالیت اینترنورونهای مهاری را با یک پروتئین به نام Nav1.1 تقویت کردند. آنها دریافتند که اینترنورونهایی با عملکرد تقویت شده قادر به غلبه بر محیط سمی بیماری هستند و عملکرد مغز را بازیابی میکنند. این پژوهش جدید در مجلهی CELL منتشر شده است.
ژندرمانی
برای اولین بار، پژوهشهای جدید توانستهاند نشان دهند ریسک فاکتور ژنتیکی شناختهشده برای بیماری آلزایمر چگونه اثرش را در سلولهای مغز انسان ایجاد میکند. آنها همچنین توانستهاند این ژن را اصلاح و اثرات مخربش را حذف کنند. نقش پیچیدهی ژن آپولیپوپروتئین (APOE) در ایجاد و پیشرفت بیماری آلزایمر مورد مطالعه قرار گرفته است. برای مثال محققان میدانند که داشتن یک متغیر ژنی APOE4 خطر بروز آلزایمر را دو تا چهار برابر افزایش میدهند. داشتن دو نسخه از این متغیر ژنتیکی نیز با افزایش ۱۲ برابری احتمال ابتلا همراه است. APOE در ترکیب با چربیها، آپولیپوپروتئین را ایجاد میکند. آپولیپوپروتئین به انتقال و تنظیم سطوح کلسترول در جریان خون کمک میکند.
اما نسخهی E4 از این ژن برای مغز مخرب است. چندین مطالعه نشان دادهاند که این متغیر ژنتیکی خطر تشکیل مواد سمی آمیلوئید-بتا و تائو را افزایش میدهد. پژوهشگران دریافتند که پروتئین APOE4 در مغز انسان، ترکیب پاتوژنیک دارد. یعنی در مغز شکل غیرنرمالی دارد که نمیگذارد پروتئین درست کار کند. این شکل غیرنرمال به یکسری مشکلات ایجادکنندهی بیماری میانجامد. نورونهای بیانکنندهی APOE4 سطوح فسفریلاسیون تائوی بالاتری دارند. همچنین، تولید پپتیدهای آمیلوئید-بتا نیز در این افراد بالاتر است که به از بین رفتن نورونهای گاباارژیک میانجامد. سطوح بالای فسفریلاسیون تائو ربطی به افزایش تولید پپتیدهای آمیلوئید-بتا ندارد. این پژوهش در مجلهی نیچر متشر شده است.
رژیم MIND
زوالعقل و کاهش عملکرد مغز ازجمله مواردی است که با افزایش سن گریبانگیر بسیاری از افراد میشود. مغز نیز همانند سایر اعضای بدن برای عملکرد بهتر به تغذیه مناسب نیاز دارد. رژیم MIND برای جلوگیری از زوال عقل و نیز جلوگیری از روند کاهش عملکرد مغز طراحی شده است. این رژیم ترکیبی از رژیم مدیترانهای و رژیم DASH (رژيم غذایی برای متوقف کردن فشار خون بالا) است که با هدف ایجاد یک الگوی غذایی مخصوص برای حفظ سلامت مغز طراحی شده است. این نوع رژیم غذایی بر روی ذهن و قدرت مغز تمرکز دارد. رژیم مدیترانهای بر اساس غذاهای محلی و ناحیهای است و بیشتر بر روی میوهها، سبزیجات، حبوبات، عدس و غلات سبوسدار تمرکز دارد و مصرف گوشت قرمز، لبنیات، شیرینیها و غذاهای حاوی چربی را محدود میسازد.

روغن زیتون حاوی اسیدهای چرب غیراشباعی است و میتواند مزایای خوبی برای سلامتی قلب بههمراه داشته باشد. به همین دلیل، این روغن جایگاه ویژهای در رژیم غذایی MIND دارد. پژوهش انجامشده پیرامون رژیم MIND، نتوانست چگونگی عملکرد دقیق آن را نشان دهد. با اینحال دانشمندانی که این رژیم را طراحی کردهاند بر این عقیدهاند که رژیم MIND میتواند از طریق کاهش استرس اکسیداتیو و کاهش التهاب، تاثیر خود را اعمال کند. استرس اکسیداتیو زمانی رخ میدهد که مولکولهای ناپایدار به نام رادیکالهای آزاد به مقدار زیادی در بدن انباشته میشوند. این حالت اغلب به آسیب سلولها منجر میشود.
مغز نیز بهطور خاص نسبت به این حالت آسیبپذیر است. التهاب درواقع همان پاسخ طبیعی بدن نسبت به آسیبدیدگی و عفونت است. اما اگر بهدرستی تنظیم نشود، میتواند مضر باشد و در ابتلا به بسیاری از بیماریهای مزمن نقش داشته باشد. استرس اکسیداتیو و التهاب در مجموع میتوانند برای مغز مضر باشند. این دو عامل در سالهای اخیر، مولفهی اصلی برخی از روشها برای جلوگیری و درمان بیماری آلزایمر بودهاند. پیروی از رژیمهای مدیترانهای و DASH در کاهش سطح استرس اکسیداتیو و التهاب نقش دارد. از آنجایی که رژيم MIND ترکیبی از این دو دستور غذایی است، پس میتوان نتیجه گرفت که احتمالا اثرات آنتیاکسیدانی و ضدالتهابی را بههمراه خواهد داشت. آنتیاکسیدان موجود در توتها و ویتامین E موجود در روغن زیتون، سبزیجات برگدار و مغزها میتوانند از طریق حفاظت در برابر استرس اکسیداتیو، به بهبود عملکرد مغز کمک کنند.
علاوه بر این، اسیدهای چرب امگا ۳ موجود در ماهی به تاثیر مثبت کاهش التهاب در مغز شهرت دارند؛ همچنین سرعت از بین رفتن عملکرد مغز را کاهش میدهند. پژوهشگران همچنین معتقدند که رژیم MIND میتواند از طریق کاهش پروتئینهای آمیلوئید-بتا، فوایدی را برای مغز بههمراه داشته باشد. مطالعات حیوانی و آزمایشگاهی نشان دادهاند که آنتیاکسیدانها و ویتامینهای موجود در مواد غذایی توصیهشده در رژیم MIND، در جلوگیری از تشکیل پلاکهای آمیلوئید-بتا در مغز نقش دارند. رژیم MIND همچنین خوردن غذاهای حاوی چربیهای اشباعشده و چربیهای ترانس را محدود میکند. تحقیقات نشان دادهاند که این غذاها باعث افزایش سطح پروتئین آمیلوئید-بتا در مغز موشها میشود. پژوهشگران با مطالعات انسانی به این نتیجه رسیدهاند که مصرف این چربیها میتواند خطر ابتلا به آلزایمر را دو برابر کند.

