آغازی بر دنیای کوانتوم: اتم و مدلهای اتمی

شناخت اتم، سر آغاز شناخت مواد و اجزای سازنده در جهان است. برای شناخت جهان پهناورمان باید از کوچکترین واحدها شروع کنیم.
گفته میشود که انسان در قرن بیستم توانست قدرت اتم را تحت کنترل خود در بیاورد. ما بمبهای اتمی ساختیم و با استفاده از توان هستهای، الکتریسیته تولید کردیم. ما حتی اتم را به بخشهای کوچکتری بهنام ذرات زیراتمی تبدیل کردیم.
اما یک اتم درحقیقت چیست؟ از چه موادی تشکیل شده است؟ به چه شکلی است؟ ساختار اتم و ویژگیهای مربوطبه آن زمینههای زیادی در علوم شیمی و فیزیک را دربرمیگیرد و شاید حتی یکی از بزرگترین بخشهای علوم مدرن باشد. ما در این مقاله به داستانهای جالب در اکتشافات علوم مختلف میپردازیم؛ اکتشافاتی که بینش امروزی ما از اتم را تشکیل میدهند. ابتدا به ترتیب درمورد ساختار اتم و چگونگی تأثیر ساختار آن بر فناوریهای جدید میپردازیم.

اتم؛ میراثی از دورههای دوردست تا قرن نوزدهم
دیدگاه مدرن در مورد اتم از زمینههای مختلفی در شیمی و فیزیک نشات میگیرد. ایدهی اتم از علوم و فلسفه یونان باستان و همچنین نتایج علم شیمی قرن ۱۸ و ۱۹ سرچشمه میگیرد و موارد زیر را دربردارد:
- مفهوم اتم
- اندازهگیری جرم اتمی
- رابطه تکرارشونده و یا تناوبی بین عناصر
مفهوم اتم
از زمان یونان باستان تاکنون ما همیشه در این فکر بودیم که یک مادهی معمولی از چه موادی تشکیل شده است. برای اینکه سوال را بهتر درک کنید به توضیح سادهای از کتابی به نام ساختار The Extraordinary Chemistry of Ordinary Things, 3rd Edition از کارل اچ.اسنایدر میپردازیم:
۲. گیرهها را به دو دسته مساوی تقسیم کنید
۳. دوباره هر دسته را به دو دسته مساوی دیگر تقسیم کنید
۴. تقسیم کردن را تا جایی ادامه دهید که تنها یک گیره باقی بماند. این تک گیره باز هم کار نگه داشتن کاغذ را بهخوبی انجام میدهد.
۵. حالا با استفاده از یک قیچی گیره را از وسط ببرید. آیا گیره نصفشده میتواند کار نگه داشتن کاغذ را انجام دهد؟
اگر شما فرآیند بالا را درمورد عناصر هم انجام دهید، درنهایت به یک بخش غیرقابل تقسیم میرسید که آن بخش (کوچکترین بخش) خواص یکسانی با کل مجموعهی عنصر دارد. بخش غیرقابل تقسیم، اتم نام دارد.
ایده اتم ابتدا در سال ۵۳۰ قبل از میلاد مسیح توسط دموکریت مطرح شد. در سال ۱۸۰۸ یک معلم مدرسه انگلیسی بهنام جان دالتون نظریه اتمی مدرن را مطرح کرد. طبق نظریه اتمی مدرن با زبان ساده:
- هر عنصری از اتمهایی تشکیل شده است (مانند گیره کاغذ).
- تمامی اتمهای عنصر یکسان هستند (همه گیرههای کاغذ اندازه و رنگ یکسانی داشتند).
- اتمهای عناصر مختلف، متفاوتاند (از نظر اندازه و خواص) همانطور که اندازه و رنگ گیرههای کاغذ متفاوت است.
- اتمهای عناصر خاص با پیوند با یکدیگر، یک ترکیب را تشکیل میدهند. (شما میتوانید با چند گیره مختلف، ساختارهای جدیدی را به وجود بیاورید)
- اتمها در واکنشهای شیمیایی ساخته نمیشوند، از بین نمیروند، و یا تغییر نمیکنند (هیچ گیره کاغذی خودبه خود ظاهر نمیشود، از بین نمیرود و یا اندازه و رنگ آن تغییر نمیکند)
- تعداد انواع اتمها در هر ترکیبی ثابت است (مجموع و انواع گیرههای کاغذی که شما کارتان را با آنها شروع میکنید ثابت است)
نظریهی اتمی دالتون پایه و اساس شیمی آن زمان را شکل داد. دالتون اتمها را مانند کرههای کوچکی میدید که بهوسیله قلابهایی به اتمهای ویژهی دیگری، به مقدار مشخصی متصل میشدند. اما برخی از عناصر میتوانند ترکیب شوند و ترکیب متفاوتی را بهوجود بیاورند (مثلا هیدروژن و اکسیژن میتوانند آب یا هیدروژن پراکسید را بهوجود بیاورند). بنابراین دالتون نتوانست درمورد تعداد هر اتم در مولکولهای مواد خاص حرفی بزند؛ مثلا اینکه آیا آب دارای یک اکسیژن و یک هیدروژن است، یا دارای یک اکسیژن و دو هیدروژن است؟ تعداد زمانی مشخص شد که شیمیدانها توانستند شمار اتمها را اندازهگیری کنند.
پیش از ادامهی متن به چند اصطلاح مهم که احتمالا از دوران دبیرستان بهیاد دارید میپردازیم:
- اتم: کوچکترین بخش یک عنصر که خواص شیمیایی آن عنصر را دربردارد.
- ترکیب: مادهای که میتواند با واکنش شیمیایی به عناصر مختلف شکسته شود.
- الکترون: ذرهای با بار منفی که به دور هسته اتم میچرخد (جرم= ۹.۱۰ × ۱۰-۲۸ گرم)
- عنصر: موادی که با واکنشهای شیمیایی به بخشهای کوچکتری تقسیم نمیشوند.
- یون: اتمی با بار الکتریکی (یعنی بار اضافی مثبت یا منفی)
- مولکول: کوچکترین بخش ترکیب که خواص شیمیایی ترکیب را درخود دارد ( از دو یا چند اتم تشکیل شده است)
- نوترون: ذرهای بدون بار در هسته اتم (جرم= ۱.۶۷۵ ×۱۰-۲۴ گرم)
- هسته: بخش مرکزی متراکم اتم ( که از پروتون و نوترون تشکیل شده است)
- پروتون: ذرهای با بار مثبت در هسته اتم (جرم= ۱.۶۷۳ × ۱۰-۲۴ گرم)
وزن اتمها چقدر است؟
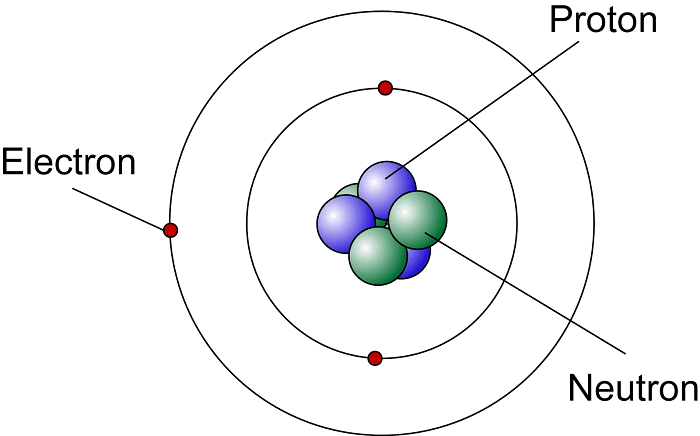
سادهترین مدل یک اتم
توانایی اندازهگیری کمی اتمها توسط مشاهدات یک شیمیدان ایتالیایی بهنام آمادئو آووگادرو مطرح شد. آووگادرو روی گازها (نیتروژن، هیدروژن، اکسیژن و کلر) کار میکرد و متوجه شد که وقتی دما و فشار یکسان باشند، این گازها با حجم مشخصی ترکیب میشوند. بهعنوان مثال:
- یک لیتر نیتروژن با سه لیتر هیدروژن ترکیب میشود و آمونیاک (NH3) را تولید میکند.
- یک لیتر هیدروژن با یک لیتر کلر ترکیب میشود و هیدروژن کلرید (HCl) را تولید میکند.
طبق بیان آووگادرو، تحت دما و فشار یکسان، حجمی مساوی از گازها دارای تعداد ثابتی از مولکولها هستند. بنابراین با اندازهگیری حجم گازها میتوان جرم اتمی را مشخص کرد. بهعنوان مثال، یک لیتر اکسیژن ۱۶ برابر سنگینتر از یک لیتر هیدروژن است؛ بنابراین جرم اتم اکسیژن باید ۱۶ برابر جرم اتم هیدروژن باشد. چنین کاری منجربه مقیاس جرمی نسبی عناصر شد که در آن همهی عناصر نسبت به کربن (استاندارد ۱۲) ارزیابی میشوند. زمانی که مقیاس جرم نسبی شکل گرفت، آزمایشهای بعد از آن توانستند جرم مواد بر حسب گرم را به تعدادی از اتمها و واحد جرم اتمی نسبت دهند. هر یک واحد جرم اتمی یا دالتون برابر است با ۱۰۲۴ × ۱/۶۶.
شیمیدانها در آن زمان به جرم اتمی عناصر و خواص شیمیایی آنها پی بردند و با پدیدهی جدیدی روبرو شدند.
خواص عناصر، یک الگوی تکرارشونده را نشان دادند
زمانی که جرم اتمی کشف شد، شیمیدانی روسی بهنام دیمیتری مندلیف شروعبه نوشتن یک کتابچه کرد. او برای نوشتن کتابچهی خود، ابتدا شروع به مرتب کردن عناصر با توجهبه خواص آنها کرد و اتمها را با توجه به جرم اتمی آنها در نظر گرفت. او عناصر را به ترتیب افزایش جرم اتمی در کنار همدیگر قرار داد و متوجه شد که عناصر با خواص مشابه در یک دوره (ردیف افقی جدول تناوبی) خاص قرار میگیرند. جدول مندلیف دارای دو ایراد بود:
- چند جای خالی در جدول وجود داشت.
- اکثر عناصر گروهبندیشده با توجهبه خواصشان و افزایش جرم اتمی، خارج از نظم و روال جدول بودند.
مندلیف برای توضیح جاهای خالی آنها را به عناصر کشفنشده نسبت داد. درواقع جدول او وجود عناصر کشفنشده (در آن زمان) گالیوم و ژرمانیوم را پیشبینی کرده بود. این عناصر بعدا کشف شدند. اما مندلیف موفق نشد که دلیل خارج از نظم بودن عناصر و اینکه چرا آنها در دورهای خاص چنین رفتاری دارند، توضیح دهد. درواقع فهمیدن دلیل چنین موضوعاتی نیازمند دانش اساسی درمورد ساختار اتم بود.
ساختار اتم: علوم اوایل قرن بیستم
برای اینکه ساختار اتم را بشناسیم ابتدا باید پاسخ پرسشهای زیر را بدانیم:
- اتم چه بخشهایی دارد؟
- نحوهی قرارگیری این بخشها چگونه است؟
تا اواخر قرن نوزدهم، نظریهی اتمی دالتون پابرجا بود (اتم تنها یک کره کوچک غیرقابل دیدن است). اما مجموعهای از کشفها در علوم شیمی، الکتریسیته، مغناطیس، رادیواکتیویته یا پرتوزایی، مکانیک کوانتومی در اواخر قرن ۱۹ و اوایل قرن ۲۰ همهی موارد قبلی را تغییر داد. در زیر به چند زمینهی جدید کشفشده توسط این علوم میپردازیم:
- بخشهای یک اتم: علم شیمی و الکترومغناطیس باعث کشف الکترون (اولین ذره زیراتمی) شد.
رادیواکتیویته هم باعث کشف پروتون، نوترون و هسته شد.
- نحوه قرارگیری بخشهای اتم: مکانیک کوانتومی تمامی بخشهای اتم را بهصورت یکجا مورد بررسی قرار میدهد: طیف اتمی و مدل اتمی بور و همچنین دوگانگی موج و ذره از مکانیک کوانتومی بهدست آمدند.
شیمی و الکترومغناطیس: کشف الکترون
شیمیدانان و فیزیکدانان در اواخر قرن نوزدهم روی رابطه بین الکتریسیته و ماده مطالعاتی انجام دادند. آنها جریان الکتریکی ولتاژ بالایی را از لولههای شیشهای پر از گاز کمفشار (جیوه، نئون، و زنون) عبور دادند. جریان الکتریکی از یک الکترود (کاتد) گاز به الکترود دیگری (آند) بهوسیله اشعهای بهنام پرتو کاتدی انتقال پیدا میکرد. در سال ۱۸۹۷،جوزف جان تامسون، فیزیکدان بریتانیایی آزمایشهایی انجام داد و به نتایج زیر دست یافت:
- اگر محفظهای در یک میدان مغناطیسی یا الکتریکی قرار بگیرد، پرتو کاتدی میتواند شکسته و منحرف شود یا حتی حرکت کند (لامپ پرتوی کاتدی داخل تلویزیونهای نسلهای قبلی همینگونه کار میکند).
- ·تامسون توانست با استفاده از میدان الکتریکی تنها، یا میدان مغناطیسی تنها و یا ترکیب آنها، نسبت بار الکتریکی به جرم پرتوهای کاتدی را اندازهگیری کند.
- او همچنین متوجه شد نسبت بار به جرم پرتوهای کاتدی وابستهبه ماده داخل محفظه و یا جنس کاتدنیست.
تامسون چنین نتیجه گرفت:
- پرتوهای کاتدی از ذرات ریزی با بار منفی ساخته شدهاند. او این ذرات را الکترون نامید.
- الکترونها باید از داخل اتمهای گاز یا الکترود فلزی بیرون آمده باشند.
- چون نسبت بار به جرم برای هر مادهای ثابت است، پس الکترونها یکی از بخشهای اصلی همه اتمها هستند.
- چون نسبت بار به جرم الکترون بسیار بالاست، پس الکترون باید بسیار کوچک باشد.
در ادامه، رابرت میلیکان، فیزیکدان آمریکایی، بار الکتریکی یک الکترون را اندازهگیری کرد. فیزیکدانان با استفاده از این دو مقدار (بار و نسبت بار به جرم) جرم الکترون را محاسبه کردند (۱۰۲۸ × ۹/۱۰ گرم). برای اینکه اندازه جرم الکترون را بهتر متوجه شوید، از وزن ۲/۵ گرمی یک پنی آمریکا (کوچکترین سکه در نظام پولی این کشور) استفاده میکنیم. وزن یک پنی ۲/۵ گرم است؛ یعنی معادل ۱۰۲۷ × ۲/۷ یا ۲/۷ میلیارد میلیارد میلیارد الکترون.
نتایج دیگری از کشف الکترون بهدست آمد:
- چون الکترون بار منفی دارد و اتمها از نظر بار خنثی هستند، پس باید ذرهای با بار مثبت در آنها وجود داشته باشد.
- چون الکترونها خیلی کوچکتر از اتمها هستند، پس باید ذرات دارای جرم زیادی داخل اتم وجود داشته باشند.
تامسون با استفاده از این نتایج مدلی اتمی خودش را پیشنهاد کرد که شبیه هندوانه بود. بخش قرمز هندوانه، بار مثبت داشت و تخمههای هندوانه همان الکترونها بودند.
رادیواکتیویته: کشف هسته، پروتون، و نوترون
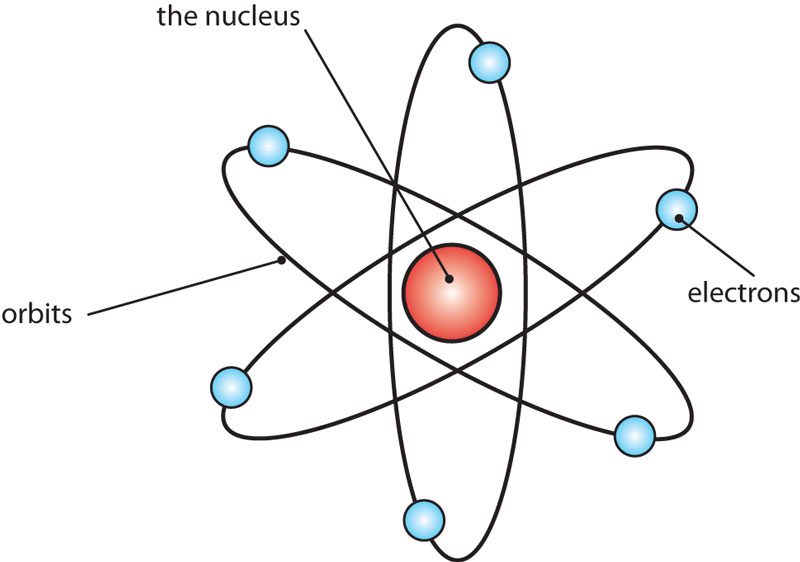 مدل اتمی رادرفورد
مدل اتمی رادرفورد
همزمان با آزمایشهای تامسون روی پرتوهای کاتدی، فیزیکدانان دیگری مثل آنری بکرل، ماری کوری، پیر کوری وارنست رادرفورد روی رادیواکتیویته مطالعه میکردند. رادیواکتیویته با ۳ پرتو کار میکرد:
ذرات آلفا: دارای بار الکتریکی مثبت و جرم سنگین. ارنست رادرفورد نشان داد که این ذرات هسته اتم هلیوم هستند.
ذرات بتا: دارای بار الکتریکی منفی و نور (بعدا بهشکل الکترون نمایش داده شدند).
پرتوهای گاما: با بار الکتریکی خنثی و بدون جرم (یعنی انرژی).
آزمایشهای روی رادیواکتیویته و اکثر دانش ما درمورد ساختار اتم مدیون رادرفورد و همکارانش است. رادرفورد ورق نازکی از طلا را با ذرات آلفا بمباران کرد و روی یک صفحه فلوروسنت به اشعهها نگاه کرد و نتیجه گرفت:
تمام ذرات مستقیما بهسمت ورق حرکت میکنند و به صفحه برخورد میکنند. تعدادی از ذرات (۰/۱ درصد) منحرف میشوند یا در جلوی ورق طلا (با زاویههایی مختلف) پخش میشوند، درحالیکه بقیه در پشت ورق پخش میشوند.
رادرفورد نتیجه گرفت که اتمهای طلا دارای فضای خالی زیادی هستند که به اکثر ذرات آلفا اجازه عبور میدهند. اما بخش کوچکی از اتم باید جرم و چگالی زیادی داشته باشد تا ذرات آلفا را منحرف کند. او این بخش متراکم اتم را هسته نامید. اکثر جرم اتم در هسته قرار دارد. بعدا رادرفورد اتم نیتروژن را با ذرات آلفا بمباران کرد و ذرهای با بار مثبت که سبکتر از ذرات آلفا بود، متساعد شد. او این ذرات را پروتون نامید و متوجه شد که پروتونها در هسته هستند. پروتون دارای جرمی معادل ۱۰۲۴ × ۱/۶۷۳ گرم است و حدود ۱۸۳۵ برابر سنگینتر از الکترون است.
اما پروتونها تنها ذرهی موجود در هسته نبودند، چراکه مقدار پروتونها در عناصر کمتر از جرم کل هسته بود. بنابراین ذرهی سوم و خنثی دیگری هم باید در اتم وجود داشته باشد. جیمز چادویک، فیزیکدان بریتانیایی و همکار رادرفورد ذره زیراتمی سوم و خنثی یعنی نوترون را کشف کرد. چادویک ورقی از بریلیوم را با ذرات آلفا بمباران کرد و متوجه خارج شدن یک تابش خنثی شد. تابش خنثی میتوانست درعوض پروتونهای هستههای سایر مواد را خارج کند. چادویک نتیجه گرفت که این تابش از نظر بار الکتریکی خنثی است و جرمی تقریبا برابر با پروتون دارد. جرم نوترون ۱۰۲۴ × ۱/۶۷۵ گرم است.
حالا که بخشهای مختلف اتم مشخص شدند؛ باید نحوهی قرار گرفتن آنها در اتم مشخص میشد. آزمایش ورق طلای رادرفورد نشان داد که هسته در مرکز اتم قرار دارد و اکثر فضای اتم خالی است. بنابراین او اتم را مانند هستهای با بار مثبت در نظر گرفت که الکترونها با بار منفی بهدور آن میچرخند ( شبیه یک سیاره به همراه قمرهایی که بهدور آن میچرخند). اگرچه او گواهی برای اثبات چرخش الکترونها بهدور هسته نداشت، ولی مدل اتمی او بهنظر معقول میرسید؛ البته بازهم دارای یک مشکل بود: با چرخش الکترونها بهدور هسته، آنها باید انرژی و نور خود را از دست میدادند و در نتیجه متوقف میشدند؛ مانند ماهوارهای که بعد از تمام شدن انرژیاش سقوط میکند. درحقیقت اتم رادرفورد باید تنها در کسری از ثانیه سقوط میکرد ولی اینگونه نبود، پس یا یک جای کار میلنگید، یا اینکه هنوز کشف نشده بود.
مکانیک کوانتومی: مدلی که همه حالتها را با هم ترکیب کرد
همزمان با کشفهای رادیواکتیویته، فیزیکدانان و شیمیدانان روی چگونگی تعامل نور و ماده مطالعه میکردند. مطالعات آنها پاگشای رشته مکانیک کوانتومی بود و به حل معمای ساختار اتم کمک زیادی کرد.
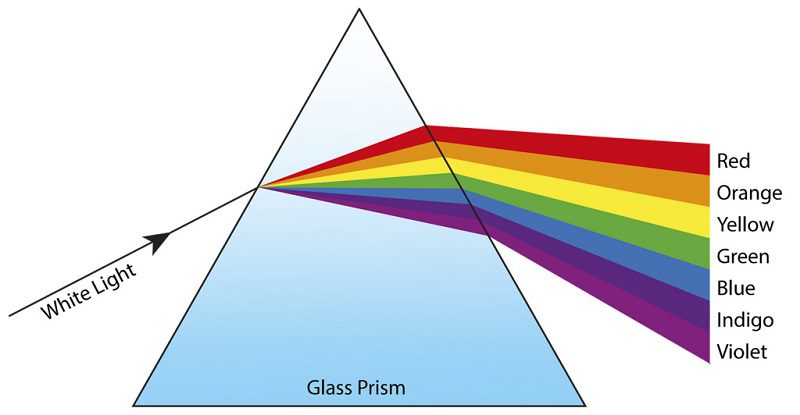
مکانیک کوانتومی و روزنهای به اتم: مدل بور
فیزیکدانان و شیمیدانان ماهیت نور خارجشده از جریان الکتریکی عبورکننده از محفظههای دارای عناصر گازی (هیدروژن، هلیوم، و نئون) و هنگام گرما دیدن عناصر در شعله (سدیم، پتاسیم، کلسیم و غیره) را مورد مطالعه قرار دادند. آنها نور را از این منابع به داخل یک طیفسنج هدایت کردند (طیفسنج دستگاهی حاوی شکافی باریک و یک منشور شیشهای است).
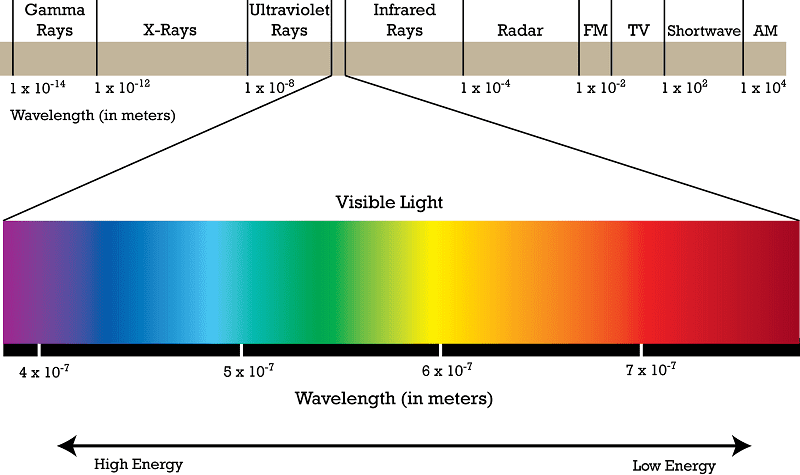
طیف پیوسته نور سفید
اگر نور خورشید را از داخل یک منشور عبور دهید، طیف مستمری از رنگهای رنگینکمان را بهدست میآورید. اما زمانی که شیمیدانان و فیزیکدانان نور گسیلشده از این منابع (نور عناصر گازی و گرمادیده) را از منشور عبور دادند، با یک پسزمینهی تاریک همراه با برخی خطوط جدا و گسسته روبرو شدند.
هر عنصر طیف منحصربهفردی داشت و طول موج هر خط داخل طیف، دارای انرژی خاصی بود.
نیلز بور، فیزیکدان دانمارکی در سال ۱۹۱۳ با ادغام یافتههای قبلی رادرفورد و با نتایج بهدست آمده از طیف و بررسی نور، مدل اتمی جدیدی مطرح کرد. طبق مدل اتمی بور، الکترونهای درحال چرخش بهدور هستهی اتم، تنها دارایسطح مشخصی از انرژی هستند (منظور همان فاصله از هسته است). زمانی که اتمهای داخل محفظهی گازی، انرژی جریان الکتریکی را جذب میکنند، الکترونها برانگیخته میشوند و از انرژی سطح پایین (نزدیک به هسته) به انرژی سطح بالا (از هسته دورتر میشوند) میرسند. الکترونهای برانگیخته با برگشت به حالت اصلی و اولیه خود، انرژی را بهشکل نور ساطع میکنند. از آنجایی که تفاوت بین سطوح انرژی اندازهای مشخص دارد، تنها طول موجهای خاصی از نور در طیفسنج دیده میشوند (همان خطوط داخل طیفسنج).
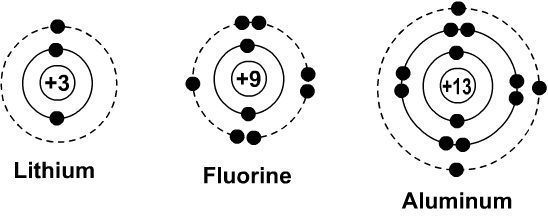 مدل بور برای اتمهای مختلف
مدل بور برای اتمهای مختلف
مدل اتمی بور در موارد زیادی به کار آمد و توضیحاتی ارائه داد:
- طیف اتمی (که در بالا توضیح دادیم)
- رفتار تناوبی عناصر: اتمهای دارای خواص مشابه، طیف اتمی یکسانی دارند.
- هر لایه الکترونی با اندازه و انرژی مشخص تنها میتواند تعداد مشخصی الکترون در خود نگه دارد. بهعنوان مثال اولین لایه الکترونی تنها میتواند دو الکترون در خود نگه دارد؛ دومین لایه ۸ الکترون، سومین لایه ۱۸ الکترون، چهارمین لایه ۳۲ الکترون و همینطور تا آخر (لایه هفتم).
- وقتی لایه پر از الکترون شد، الکترونها به لایههای با سطح انرژی بالاتر میروند.
- خواص شیمیایی عناصر وابستهبه تعداد الکترونهای آخرین لایه الکترونی است. عناصری که لایه الکترونی آخر آنها پر باشد واکنشی نشان نمیدهند (گازهای نجیب). سایر عناصر با گرفتن و یا از دست دادن الکترونهای لایه آخر خود واکنش نشان میدهند.
مدل بور برای توضیح رفتار لیزرها هم مناسب است، اگرچه چنین دستگاههایی در اواسط قرن بیستم اختراع شدند.
مدل بور بهترین مدل اتمی شناختهشده در زمان خودش بود؛ تا اینکه کشفهای جدیدی در مکانیک کوانتومی صورت گرفت.
مکانیک کوانتومی را در یک جمله چنین تعریف میکنیم: شاخهای از علم فیزیک که با حرکات ذرات بهوسیله خواص موج آنها در سطوح اتمی و زیراتمی سر و کار دارد.
الکترونها میتوانند مانند امواج رفتار کنند: مدل کوانتومی اتم
اگرچه مدل بور برای توضیح چگونگی کارکرد طیف اتمی مناسب و کافی بود؛ ولی سوالاتی هم برای فیزیکدانان و شیمیدانان بهوجود میآورد. پرسشهایی از این دست:
- چرا الکترونها باید در سطح مشخصی از انرژی گیر کنند؟
- چرا الکترونها همیشه و در همه وقت نور ساطع نمیکنند؟ اگر الکترونها در مدار دایرهای شکل مسیر خود تغییر جهت میدهند (شتاب میگیرند) باید نور ساطع کنند.
- مدل بور میتوانست طیف اتمی عنصر با یک الکترون در لایه خارجی را بهخوبی توضیح دهد، ولی در توضیح آنهایی که بیش از یک الکترون در لایه خارجی داشتند، زیاد خوب نبود.
- چرا تنها دو الکترون در لایه اول، ۸ الکترون در لایه دوم و … قرار میگیرد؟ چه مورد خاصی در مورد اعداد ۲ و ۸ وجود دارد؟
طبق گفته فیزیکدانی بهنام لویی دو بروی در سال ۱۹۲۴، الکترونها هم مانند نور میتوانند هم بهعنوان ذرات و هم بهعنوان موج رفتار کنند. فرضیه دوبروی بسیار سریع در طی آزمایشها تأیید شد. طبق آزمایشها، پرتوهای الکترون هم میتوانستند مانند نور شکسته یا منحرف شوند. بنابراین امواج تولیدشده توسط یک الکترون که در مداری مشخص بهدور هسته محصور شده است، طول موج، انرژی و فرکانس (سطوح انرژی مدل بور) مشخصی دارد؛ تقریبا شبیه عملکرد تارهای گیتار موقع نوازندگی.
سوال دیگری فورا بعد از ایده دوبروی مطرح شد: اگر الکترون بهعنوان یک موج جابهجا میشود، آیا موقعیت دقیق الکترون در موج مشخص است؟ فیزیکدانی آلمانی بهنام ورنر هایزنبرگ، به این سوال پاسخ منفی داد. او اصل عدم قطعیت را مطرح کرد:
- برای دیدن الکترون در مدارش باید طول موجی از نور را به آن تاباند که کوچکتر از طول موج الکترون باشد.
- این طول موج کوچک از نور، انرژی زیادی دارد.
- الکترون انرژی آن را جذب خواهد کرد.
- انرژی جذبشده، موقعیت الکترون را تغییر خواهد داد.
ما هرگز نمیتوانیم مکان و تکانه الکترون در اتم را مشخص کنیم. بنابراین طبق گفتهی هایزنبرگ، الکترونها در مسیرهای تعریفشدهای بهدور هسته حرکت نمیکنند.
در سال ۱۹۲۶ فیزیکدانی استرالیایی بهنام اروین شرودینگر با در نظر گرفتن فرضیه دوبروی و همچنین اصل عدم قطعیت هایزنبرگ، معادلات (معادله شرودینگر) یا توابعی موجی را برای الکترونها بهدست آورد. براساس تئوری شرودینگر، الکترونها در مدارهای خود محدود هستند و میتوانند امواجی داشته باشند که ما با استفاده از آن مکان نسبی و احتمالی آنها را توصیف کنیم. توزیع احتمالات، مکانهایی از فضای دور هسته بهنام اوربیتال بهوجود میآورد. اوربیتالها بهنوعی ابرهای چگالی الکترونی هستند. متراکمترین قسمت ابر الکترونی جایی است که احتمال وجود الکترون در آن بیشتر از همهجاست و برعکس کمتراکمترین بخش جایی است که احتمال یافتن الکترون در آن کمتر از همهجاست.
توابع موج
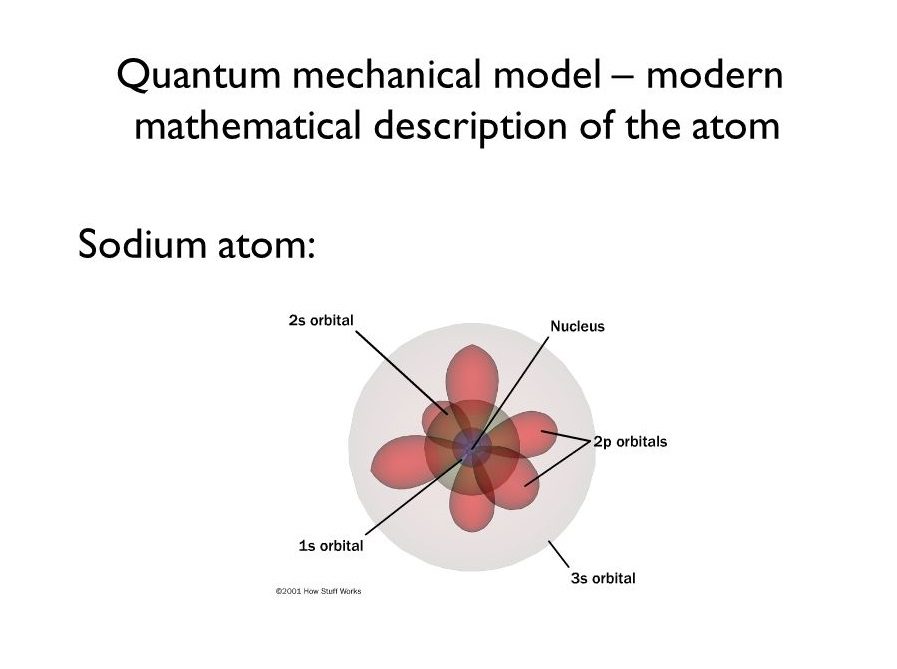
مدل کوانتومی اتم سدیم
تابع موجی هر الکترون مجموعهای از سه عدد کوانتومی است:
- عدد کوانتومی اصلی که با n نمایش داده میشود، نشاندهنده تراز انرژی است.
- عدد کوانتومی اوربیتالی که با حرف l نشان داده میشود، مقدار سرعت حرکت الکترون در مدارش (تکانه زاویهای) را نشان میدهد (مانند سرعت چرخش لوح فشرده). این عدد به شکل اوربیتال وابسته است.
- عدد کوانتومی مغناطیسی که با m نمایش داده میشود، جهتگیری اوربیتالها در فضا را مشخص میکند.
در ادامه مشخص شد که هیچ دو الکترونی نمیتوانند در یک سطح از انرژی حضور داشته باشند، بنابراین عدد کوانتومی چهارمی هم به تابع موجی اضافه شد. این عدد مربوطبه مسیر اسپین و چرخش الکترون به دور خودش در هنگام حرکت در مدار است (یعنی اینکه الکترون در جهت عقربههای ساعت به دور خودش میچرخد یا خلاف آن). تنها دو الکترون میتوانند در یک اوربیتال حضور داشته باشند: یک الکترونی که در جهت عقربههای ساعت گردش میکند و الکترون دیگری که در خلاف جهت عقربههای ساعت گردش میکند.
اوربیتالها در هر ترازی از انرژی، شکلهای مختلف دارند و به تعداد خاصی میتوانند در فضا قرار بگیرند:
- اوربیتال s: شکلی کروی دارد و تنها به ۱ حالت میتواند در فضا قرار بگیرد.
- اوربیتال p: دمبلی شکل است و به ۳ حالت میتواند در فضا قرار بگیرد.
- اوربیتال d: چهار قسمتی است و حداکثر ۵ مدل جهتگیری دارد.
- اوربیتال f: شش قسمتی است و حداکثر ۷ مدل جهتگیری دارد.
اسامی اوربیتالها قبل از ابداع مکانیک کوانتومی و از مشخصههای طیف اتمی گرفته شده است. هر اوربیتال میتواند تنها دو الکترون را در خود نگه دارد. همچنین نحوه پرشدن اوربیتالها هم خاص است و معمولا:
- ممکن است همپوشانی وجود داشته باشد (جزئیات آن در کتابهای شیمی آمده است)
- مدل بهدست آمده از اتم، مدل کوانتومی اتم نام دارد.
سدیم دارای ۱۱ الکترون است که ترازهای انرژی آن به شکل زیر است:
۱. یک اوربیتال s: دو الکترون
۲. یک اوربیتال s: دو الکترون و سه اوربیتال p (هر کدام دارای دو الکترون)
۳. یک اوربیتال s: یک الکترون
درحال حاضر، مدل کوانتومی، دقیقترین ساختار شناختهشده از یک اتم است. مدل کوانتومی توضیحی درمورد اکثر دانش ما در علوم فیزیک و شیمی ارائه میدهد. در ادامه به چند مثال میپردازیم:
شیمی
جدول تناوبی: الگوی جدول تناوبی و نحوهی قرارگیری عناصر در آن براساس نحوه قرارگیری الکترونها در عناصر است. عناصر، عدد اتمی (تعداد پروتون یا الکترونها) و جرم اتمی (مجموعه تعداد پروتونها و نوترونها) متفاوتی دارند.
- ردیفها: عناصر موجود در هر ردیف از جدول، دارای تراز انرژی یکسانی است.
- ستونها: عناصر دارای تعداد یکسانی از الکترونها در خارجیترین تراز انرژی هستند (از ۱ تا ۸).
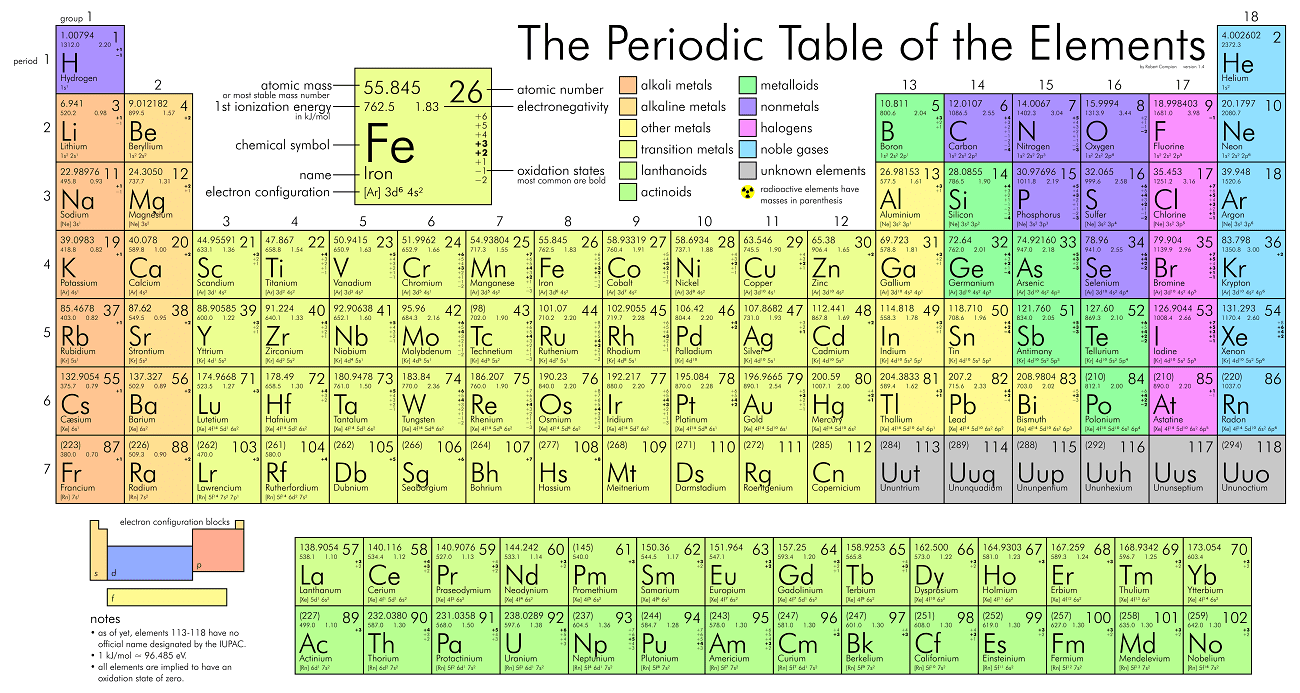
واکنشهای شیمیایی: تبادل الکترون بین اتمهای مختلف (دادن، گرفتن و یا بهاشتراکگذاری الکترون) را واکنش شیمیایی گویند. تبادل در خارجیترین تراز انرژی انجام میشود تا لایهی الکترونی خارجی اتم را تکمیل کند (یعنی پایدارترین حالت اتم).
رادیواکتیویته فیزیک
تغییرات در هستهی اتم ( فروریختن تابشی یا رادیواکتیو هسته) باعث انتشار ذرات رادیواکتیو میشود.
راکتورهای هستهای: جدا کردن هسته (شکستن یا کافش هستهای)
طیف اتمی: با تغییر دادن تراز انرژی توسط الکترونهای برانگیخته بهوجود میآید (جذب یا انتشار انرژی در قالب فوتونهای نور)
آیا میتوانیم اتمها را ببینیم؟
 عکس میکروسکوپ تونلی روبشی (۷نانومتر در ۷ نانومتر) از یک زنجیره زیگزاگی اتمهای سزیم (رنگ قرمز) روی سطح گالیم آرسنید (رنگ آبی).
عکس میکروسکوپ تونلی روبشی (۷نانومتر در ۷ نانومتر) از یک زنجیره زیگزاگی اتمهای سزیم (رنگ قرمز) روی سطح گالیم آرسنید (رنگ آبی).
اتمها بهاندازهای کوچک هستند که با چشم دیده نمیشوند و باید با میکروسکوپ آنها را ببینیم. برای اینکه اندازهی آنها را بهتر درک کنید در ادامه به قطر تقریبی اتمها و ذرات مختلف اشارهای میکنیم:
- اتم: ۱۰-۱۰ × ۱ متر
- هسته: بین ۱۰-۱۵ ×۱ تا ۱۰-۱۴ × ۱ متر
- نوترون یا پروتون: ۱۰-۱۵ × ۱ متر
- الکترون: دقیقا مشخص نیست، ولی حدس زده میشود که حدود ۱۰-۱۸ × ۱ متر باشد.
شما نمیتوانید اتم را با میکروسکوپ نوری مشاهده کنید. در سال ۱۹۸۱ نوعی میکروسکوپ بهنام میکروسکوپ تونلی روبشی (STM) ساخته شد که از بخشهای زیر تشکیل شده است:
- یک سوزن کوچک و تیز که الکتریسیته را هدایت میکند (پروب) و سطح نمونه را روبش میکند.
- یک دستگاه سریع برای اسکن اثر فشار برقی یا پیزوالکتریک.
- اجزای الکترونیکی برای رساندن جریان به سوزن یا پروب، کنترل اسکنر و دریافت سیگنالهای حسگر حرکتی.
- کامپیوتر برای کنترل سیستم و تحلیل دادهها (جمعآوری دادهها، پردازش و نمایش آنها).
میکروسکوپ تونلی روبشی به شکل زیر کار میکند:
جریانی به پروب فرستاده میشود و اسکنر بهسرعت نوک سوزن را روی سطح نمونه بهحرکت درمیآورد.
- وقتی سوزن به اتم میرسد، جریان الکترونها بین اتم و سوزن تغییر میکند.
- کامپیوتر تغییرات را با موقعیت اکس و وای اتم ثبت میکند.
- اسکنر به کارش در قرار دادن سوزن روی نقاط اکس و وای سطح نمونه ادامه میدهد و برای هر نقطه جریانی را ثبت میکند.
- کامپیوتر دادهها را جمعآوری میکند و نقشهای از جریان در سطح نمونه تهیه میکند که مطابق نقشهای از موقعیتهای اتمی است.
چنین فرایندی بیشتر شبیه یک گرامافون است که سوزن آن نقش پراب را بازی میکند و شیارهای صفحه گرامافون همان اتمها هستند. سوزن STM با حرکت روی سطح نمونه، از یک جریان تونلی بهعنوان شناساگر حساس موقعیت اتمی استفاده میکند.
STM و نمونههای دیگر چنین میکروسکوپهایی، اجازهی دیدن اتمها را به ما میدهند. بهعلاوه STM میتواند برای دستکاری اتمها مورد استفاده قرار بگیرد: اتمها میتوانند به حرکت دربیایند و تشکیل قالب بدهند تا ماشینهایی مثل موتورهای مولکولی بسازند.
 اتمها میتوانند با استفاده از سوزن استیام روی سطح نمونه قرار بگیرند و الگویی سفارشی و دستساز را روی سطح خلق کنند.
اتمها میتوانند با استفاده از سوزن استیام روی سطح نمونه قرار بگیرند و الگویی سفارشی و دستساز را روی سطح خلق کنند.
بهطور خلاصه، علم در قرن بیستم ساختار اتم را مشخص کرد. دانشمندان اکنون در حال انجام آزمایشهایی برای مشخص کردن جزئیات هسته و نیروهای نگهدارندهی آن هستند. در بخشهای بعدی به توضیح بیشتری پیرامون مکانیک کوانتوم خواهیم پرداخت.

